题目内容
9.NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 5.6g铁由原子变成离子时,失去的电子数一定为0.2NA | |
| B. | 0.2NA个硫酸分子与19.6g磷酸含有相同的氧原子数 | |
| C. | 28g氮气所含的原子数为NA | |
| D. | NA个氧分子与NA个氢分子的质量比为8:1 |
分析 A、求出铁的物质的量然后根据反应后铁元素的价态可能为+2价或+3价来分析;
B、0.2NA个硫酸分子的物质的量为0.2mol,19.6g磷酸的物质的量n=$\frac{19.6g}{98g/mol}$=0.2mol,而硫酸和磷酸分子中均含4个氧原子;
C、氮气由氮原子构成;
D、物质的量相等时,物质的质量之比等于摩尔质量之比.
解答 解:A、5.6g铁的物质的量为0.1mol,而反应后铁元素的价态可能为+2价或+3价,故0.1mol铁失去0.2mol电子或0.3mol电子即0.2NA个或0.3NA个,故A错误;
B、0.2NA个硫酸分子的物质的量为0.2mol,19.6g磷酸的物质的量n=$\frac{19.6g}{98g/mol}$=0.2mol,而硫酸和磷酸分子中均含4个氧原子,故0.2mol硫酸和磷酸中含0.8mol氧原子即0.8NA个,故B正确;
C、氮气由氮原子构成,故28g氮气中含有的氮原子的物质的量n=$\frac{28g}{14g/mol}$=2mol,个数为2NA个,故C错误;
D、物质的量相等时,物质的质量之比等于摩尔质量之比,故NA个氧气分子和NA个氢气分子的质量之比为32:2=16:1,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 水溶液中:Na+、K+、N03- | |
| B. | 空气中:CO2、S02、NO | |
| C. | 氢氧化铁胶体中:H+、K+、I- | |
| D. | 高锰酸钾溶液中:H+、S042-、CH3CH2OH |
17.下列实验方案能达到实验目的是( )
| A. |  用图所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| B. |  用图所示装置,制备并收集少量NO2气体 | |
| C. |  用图所示装置,可用于制备和收集乙酸乙酯 | |
| D. | 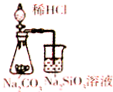 用图所示装置,证明非金属性强弱:Cl>C>Si |
4.下列分离或提纯物质的方法正确的是( )
| A. | 用酒精做萃取剂萃取碘水中的碘 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量Na2SO4 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用蒸馏的方法制取蒸馏水 |
1.某有机物的结构简式如图.下列有关它的说法正确的是( )
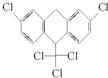

| A. | 该有机物含有一种官能团 | B. | 该有机物含有一个手性碳原子 | ||
| C. | 分子式为C14H8Cl5 | D. | 1mol该物质能与6mol H2加成 |
18.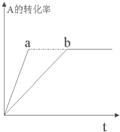 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )| A. | 增大A的浓度 | B. | 扩大容器的容积 | C. | 加入催化剂 | D. | 升高温度 |

 -CH=CHCOOCH2CH2-
-CH=CHCOOCH2CH2-
 CH=CH2+2ROH+2CO+O2CH3
CH=CH2+2ROH+2CO+O2CH3  CH=CHCOOR+2H2O
CH=CHCOOR+2H2O 或
或 (写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液,加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液,加热.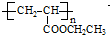 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.