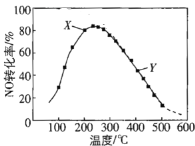
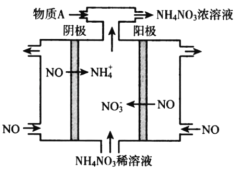
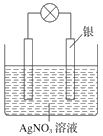
题目内容
【题目】某班学生对BeCl2是离子化合物还是共价化合物进行集体探究,从经验看铍是金属元素,易失去电子,氯元素易得到电子,请回答以下问题:
(1)Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为_________化合物。
(2)工业上制取BeCl2方法是:将得到的BeCl2溶液在HCl气流中蒸干灼烧,防止BeCl2水解,请写出BeCl2水解的化学方程式__________________。
(3)经实验验证,熔融的BeCl2不能导电,说明它是_______化合物;BeCl2能溶于水,水溶液能导电,因它在溶液中能电离,写出它的电离方程式_________。
(4)在周期表中,铍元素和铝元素恰好处于对角线位置,根据对角线法则,判断BeCl2应与_____(填MgCl2或AlCl3)化学性质更相似。
(5)0.1mol氢氧化铍恰好能和100mL0.2mol/L的氢氧化钠溶液发生反应,写出反应的化学方程式_________________。
【答案】共价 BeCl2+2H2O![]() 2HCl+Be(OH)2(没有写可逆号给1分) 共价 BeCl2=Be2+ + 2Cl— AlCl3 Be(OH)2+2NaOH=Na2BeO2+2H2O
2HCl+Be(OH)2(没有写可逆号给1分) 共价 BeCl2=Be2+ + 2Cl— AlCl3 Be(OH)2+2NaOH=Na2BeO2+2H2O
【解析】
(1)Be的电负性为1.57,Cl元素的电负性3.0,差值小于1.7,Be和Cl形成共价键,BeCl2应为共价化合物
(2)BeCl2属于强酸弱碱盐水解生成氢氧化铍,BeCl2水解的化学方程式:BeCl2+2H2O![]() 2HCl+Be(OH)2;
2HCl+Be(OH)2;
(3)熔融的BeCl2不能导电,BeCl2含的化学键是共价键,不含离子键,所以是共价化合物;BeCl2在水分子作用下断裂共价键电离产生Be2+和Cl-电离方程式为:BeCl2═Be2++2Cl-,
(4)周期表中,铍元素和铝元素恰好处于对角线位置,根据对角线法则,BeCl2应与AlCl3性质更相似;
(5)依据对角线规则,氢氧化铍性质与氢氧化铝性质,氢氧化铝与强碱反应生成偏铝酸钠,所以氢氧化铍与氢氧化钠反应的化学方程式为:Be(OH)2+2NaOH═Na2BeO2+2H2O

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
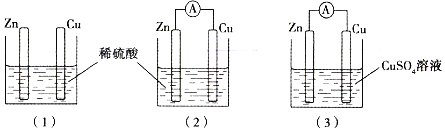
小学生10分钟应用题系列答案【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大