题目内容
【题目】某同学用如图所示装置进行实验,下列说法错误的是
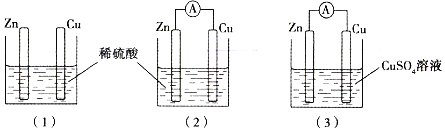
A. 若使图(1)装置中的Zn棒和Cu棒直接接触,则Cu棒上能看到有气体产生
B. 图(2)装置中SO42-向着Zn棒移动
C. 若将图(2)装置中Zn改为Mg,则Cu棒上产生气体的速率加快
D. 当图(2)装置与图(3)装置中正极生成物的质量比为1∶16时,两装置中Zn棒减轻的质量相等
【答案】D
【解析】
A、Zn、Cu直接接触就能构成闭合回路而形成原电池,稀硫酸作电解质溶液,所以Cu捧上可看到有气体产生,故A正确;
B、该原电池中锌比铜活泼,锌为负极,铜为正极,在原电池中,阴离子向负极移动,SO42-带负电荷,因此SO42-向着Zn棒移动,故B正确;
C、由于Mg失电子能力强于Zn,所以将Zn改为Mg时,电子转移速率加快,生成H2的速率也加快,故C正确;
D、图(2)装置中正极上生成氢气,图(3)装置中正极上生成铜,若图(2)装置中正极上产生2gH2,则转移2mol电子,消耗负极Zn65g,则图(3)装置中正极上析出32gCu时转移1mol电子,消耗负极Zn32.5g,即两装置中Zn棒减轻的质量不相等,故D错误;
答案选D。

【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。
【题目】下列与胶体性质无关的是( )
A.河流入海口处形成沙洲
B.冶金厂常用高压电除去烟尘
C.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
D.在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀
【题目】铅的冶炼有很多种方法。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
① 2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
② PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2=b kJ·mol-1
③ PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH3=c kJ·mol-1
反应PbS(s)+2O2(g)=PbSO4(s) ΔH=______________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为______________ (保留两位有效数字);若向容器中充入一定量的CO气体后,平衡向_________ (填“正向”、“逆向”或“不”)移动,再次达到平衡时,CO的转化率_________(填“增大”、“减小”或“不变”)。
【题目】A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
阳离子 | Na+、Al3+、Ba2+、NH4+ |
阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下①B溶液分别与C、D混合,均有白色沉淀生成②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体
回答下列问题:
(1)A所含的阳离子和C所含阳离子的半径大小____>______(填离子符号)。B所含的阴离子是________
(2)C溶液呈___性(填“酸性”或“碱性”),其原因是__________________
(用离子方程式解释)。D的化学式是____________
(3)以Pt为电极电解1L0.1mol/LB的水溶液,当电路中通过0.1mol电子时,
溶液的pH为_______(设电解过程溶液体积不变),阳极的电极反应式为 _____
(4)若将④阳极产生的气体通入A溶液中至恰好完全反应时,则溶液中各离子
浓度由大到小的排列顺序为__________________________