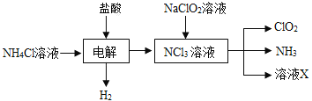
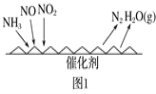
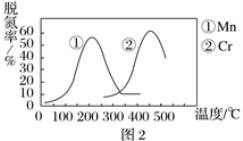
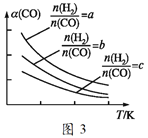
题目内容
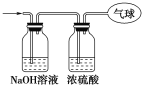
【题目】四中某学习小组依据氧化还原反应原理:2Ag++Cu=Cu2++2Ag设计成的原电池如右图所示。
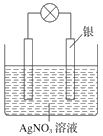
(1) 从能量转化角度分析,上述原电池将化学能转化为_________ ;
(2) 负极的电极材料为_____________;
(3) 正极发生的电极反应__________________________________;
(4) 假设反应初两电极质量相等,当反应进行到一段时间后(AgNO3溶液足量),取出两电极洗净干燥后称量,测得两电极质量差为11.2 g,则该时间内原电池反应转移的电子数为_____________。(设NA表示阿伏加德罗常数的值)
【答案】电能 Cu (或铜) Ag+ + e- = Ag 0.08NA
【解析】
(1)该装置为原电池,原电池将化学能转化为电能;
(2)原电池中活泼金属做负极,不活泼金属做正极,铜的金属活泼性比银强,因此负极的电极材料为铜;
(3)原电池中正极上得电子发生还原反应,据此写出电极反应式为;
(4)正极上的电极反应式为:Ag+ + e- = Ag,负极上的电极反应式为:Cu - 2e-=Cu2+,设转移电子物质的量为xmol,则正极上生成银的质量为xmol×108g/mol=108xg,负极上消耗铜的质量为1/2xmol×64g/mol=32xg,反应后测得两电极质量差为11.2g,据此计算转移的电子数 ;
(1)该装置为原电池,原电池将化学能转化为电能,
故答案为:电能;
(2)铜的金属活泼性比银强,铜失电子生成铜离子,银离子得电子生成银,因此负极的电极材料为铜,
故答案为:铜;
(3)正极上银离子得电子生成银,电极反应式为:Ag+ + e- = Ag,
故答案为:Ag+ + e- = Ag;
(4)正极上的电极反应式为:Ag+ + e- = Ag,负极上的电极反应式为:Cu - 2e-=Cu2+,设转移电子物质的量为xmol,则正极上生成银的质量为xmol×108g/mol=108xg,负极上消耗铜的质量为1/2xmol×64g/mol=32xg,反应后测得两电极质量差为11.2g,则108xg +32xg =11.2g,解得x=0.08mol,该时间内原电池反应转移的电子数为0.08NA,
故答案为:0.08NA ;