题目内容
【题目】化学反应原理在科研和生产中有广泛应用。
(1)难挥发性TaS2可采用如下装置提纯:将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中,反应如下:TaS2(s)+2I2(g)![]() TaI4(g)+S2(g),△H>0,下列说法正确的是:_____
TaI4(g)+S2(g),△H>0,下列说法正确的是:_____

A 在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
B 改变压强,平衡不发生移动,所以反应放出的热量不变
C 加入催化剂,改变了反应的途径,反应的△H也随之改变
D 向容器中加入更多的TaS2(s)可以提高I2(g)的转化率
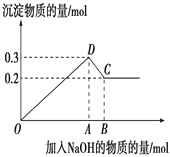
(2)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中曲线所示。

①下列说法不正确的是_____________。
A 反应2NO(g)+O2(g)![]() 2NO2(g),温度升高NO转化率增大说明正反应为吸热反应
2NO2(g),温度升高NO转化率增大说明正反应为吸热反应
B 图中X点所示条件下,延长反应时间能提高NO转化率
C 图中Y点所示条件下,增加O2的浓度能提高NO转化率
D 3800C下,C起始(O2)=5.0×10-4 mol·L-1,NO平衡转化率为50%,则平衡常数K<2000
②请在上图中画出不同温度下NO转化为NO2的平衡曲线_____。
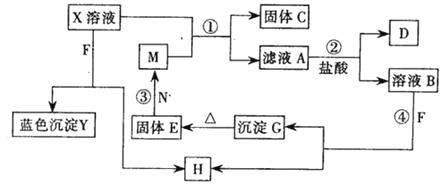
(3)电解NO可制备NH4NO3,其工作原理如下图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_________,写出电解过程的总反应化学方程式________。

【答案】AB AD  NH3 8NO+7H2O= 3NH4NO3+2HNO3,
NH3 8NO+7H2O= 3NH4NO3+2HNO3,
【解析】
⑴将TaS2与单质碘反应生成TaI4和S2,生成的产物移向另外一端石英管,在另一端石英管中反应又生成TaS2与单质碘。
⑵温度在250C左右,转化率达到最大值,小于250C是建立平衡的阶段,大于250C是温度升高,平衡逆向移动,说明该反应正反应是放热反应。温度越高转化率越低,在低温下达到平衡时,转化率越高,因此图像从最高点处逆向增大。
⑶电解NO可制备NH4NO3,阳极NO被氧化生成硝酸根离子,阴极NO被还原生成铵根离子,总的反应方程式为8NO+7H2O= 3NH4NO3+2HNO3,因此为了使电解产物全部转化为NH4NO3,需补充物质NH3,电解过程的总反应化学方程式8NO+7H2O= NH4NO3+2HNO3。
⑴A选项,在提纯过程中,I2与TaS2在高温区反应生成TaI4和S2,生成的产物移到石英管另一端,在另一端低温区反应生成I2和TaS2,因此I2的作用是将TaS2从高温区转移到低温区,故A正确;
B选项,该反应是等体积反应,改变压强,平衡不发生移动,所以反应放出的热量不变,故B正确;
C选项,加入催化剂,改变了反应的途径,但反应的△H不会改变,故C错误;
D选项,TaS2(s)是固体,向容器中加入更多的TaS2(s),平衡不移动,不能提高I2(g)的转化率,故D错误。
综上所述,答案为AB。
⑵①A选项,反应2NO(g)+O2(g)![]() 2NO2(g),250C以前是未达到平衡的阶段,250C以后是升温,转化率减小,平衡逆向移动,说明正反应为放热反应,故A错误,符合题意;
2NO2(g),250C以前是未达到平衡的阶段,250C以后是升温,转化率减小,平衡逆向移动,说明正反应为放热反应,故A错误,符合题意;
B选项,图中X点是未建立平衡的点,在该条件下,延长反应时间,向正反应进行,当达到平衡时,能提高NO转化率,故B正确,不符合题意;
C选项,图中Y点所示条件下,增加O2的浓度,平衡正向移动,NO转化率增大,故C正确,不符合题意;
D选项,3800C下,c起始(O2)=5.0×10-4 mol·L-1,NO平衡转化率为50%,
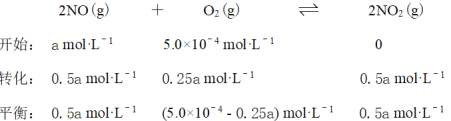
则平衡常数![]() ,故D错误,符合题意。
,故D错误,符合题意。
综上所述,答案为AD。
②根据前面分析该反应是放热反应,温度越高,转化率越小,温度越低,转化率越大,最高点是该温度下达到平衡的点,后面的点沿最高点逆向上画出平衡曲线,如图所示, ,故答案为:
,故答案为: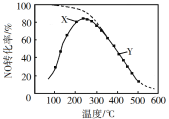 。
。
⑶电解NO可制备NH4NO3,阳极发生氧化反应,NO被氧化生成硝酸根离子,阴极发生还原反应,NO被还原生成铵根离子,总的反应方程式为8NO+7H2O= 3NH4NO3+2HNO3,因此为了使电解产物全部转化为NH4NO3,需补充物质NH3,电解过程的总反应化学方程式8NO+7H2O = 3NH4NO3+2HNO3,故答案为:NH3;8NO+7H2O= 3NH4NO3+2HNO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】资料显示“强酸性或强碱性溶液可使品红溶液褪色”。某兴趣小组探究SO2使品红溶液褪色的原因,实验如下。
Ⅰ.探究体现漂白性的主要微粒
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中。观察到前者褪色而后者不褪色。
实验二:
| 试管中的液体 | 现象 |
a.0.1mol/L SO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
d.pH=10 NaOH溶液 | 红色溶液不变色 | |
e.pH=2 H2SO4溶液 | 红色溶液不变色 |
(1)SO2水溶液中含![]() 的微粒有___。
的微粒有___。
(2)解释NaHSO3溶液显酸性的原因是___。
(3)实验d的目的是___。
(4)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是___。
Ⅱ.探究褪色过程的可逆性
甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变。
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红。
(5)实验方案合理的是___(选填“甲”或“乙”)。结合离子方程式说明其原因是___。
(6)丙同学利用SO2的还原性设计并完成了下列实验:向a实验后的无色溶液中滴入过量___(填编号),使溶液最终恢复红色。也得出结论:该褪色过程是可逆的。
A.稀硝酸 B.氯水 C.双氧水