题目内容
下列热化学方程式或说法正确的是 ( )
| A.甲烷的燃烧热为△H=-890kJ·mol-1,则 |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6kJ?mol-1 2NH3(g)△H=-38.6kJ?mol-1 |
| C.已知:H2(g)+F2(g) = 2HF(g)△H=" —270" kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
D
解析试题分析:A、甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H="-890" kJ?mol-1,错误;B、此反应为可逆反应故△H<-38.6kJ?mol-1,错误;C、气态变成液态放出热量,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于270 kJ,错误;D、此反应为放热反应,故2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和,正确。
考点:考查反应热及其计算、可逆反应等相关知识。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
相同温度下,甲(恒容)、乙(恒压)、丙(恒容)3个密闭容器中发生可逆反应:
2SO2(g)+O2(g) 2SO3(g)ΔH =" -197" kJ/mol。实验测得起始、平衡时的有关数
2SO3(g)ΔH =" -197" kJ/mol。实验测得起始、平衡时的有关数
据如下表。下列正确的是
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| SO2 | O2 | Ar | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 2 | 1 | 0 | 放出热量:Q2 |
| 丙 | 2 | 1 | 0.5 | 放出热量:Q3 |
A.Q1 =Q3<Q2
B.达到平衡时,乙容器中SO2的体积分数最大
C.平衡时,甲、乙、丙3个容器中甲的平衡常数最小
D.若在上述条件下,反应生成1molSO3(s),则反应放热为98.5kJ
下列依据热化学方程式得出的结论正确的是( )
| A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ·mol-1 则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 |
| C.已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定 |
| D.己知2C(s)+2O2(g)=2CO2(g));△H=a、2C(s)+O2(g)=2CO(g);△H=b,则a>b |
下列与化学反应能量变化相关的叙述正确的是
| A.反应物的总能量一定高于生成物的总能量 |
| B.铝与氧化铁反应既是氧化还原反应,又是吸热反应 |
| C.化学反应中发生能量变化的根本原因是化学键的断裂与形成 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
、下列反应中生成物总能量高于反应物总能量的是
| A.氧化钙溶于水 | B.乙醇燃烧 | C.铝粉与氧化铁粉末反应 | D.碳酸钙受热分解 |
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 |
| B.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C.已知H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol,则任何酸碱中和的反应热均为57.3kJ |
| D.已知2C(s)+2O2(g)=2CO2(g)△H1 |
21世纪人类正由“化石能源时代”逐步向“多能源时代”过渡,下列不属于新能源的是( )
| A.电力 | B.核能 | C.太阳能 | D.氢能 |
已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)=2H2O(l) △H1=-akJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) △H2=-bkJ·mol-1
③C(s)+1/2O2(g)=CO(g) △H3=-ckJ·mol-1
④C(s)+O2(g)=CO2(g) △H4=-dkJ·mol-1
下列说法错误的是
| A.氢气的燃烧热为△H=-akJ·mol-1 | B.c<d |
| C.一氧化碳的燃烧热为△H=-(d-c)kJ·mol-1 | D.0.5a>b |
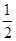 O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2