题目内容
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 |
| B.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C.已知H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol,则任何酸碱中和的反应热均为57.3kJ |
| D.已知2C(s)+2O2(g)=2CO2(g)△H1 |
D
解析试题分析:A、放热反应表明,反应物的总能量比生成物的总能量要高,而不是反应以中的一种,在本题中,应该是则SO2的与O2总能量一定高于SO3的能量,错误;B、石墨转化成金刚石吸收热量,表明金刚石的能量比石墨的高,一般来说能量越低越稳定,错误;C、若反应中除了生成水外还有别的物质如沉淀等生成,或者说生成的水不是1mol,,那么放出的热量就不一定是57.3kJ,错误;D、生成二氧化碳比生成一氧化碳的时候放出的热量多,但是反应热在比较大小时,是带着负号来比较的,所以就有:△H1<△H2,正确。
考点:考查反应热。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关反应热的说法正确的是( )
| A.任何强酸与强碱反应生成1 mol H2O的过程中,放出的热量均相同 |
| B.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| C.对于任何一个吸热反应,使用催化剂后,ΔH将降低 |
| D.已知:O=O键键能为a kJ/ mol、H-H键键能为b kJ/ mol、水蒸气中H-O键能为c kJ/ mol。又知:H2O(g)= H2O(l)ΔH=" -d" kJ/ mol。则反应2H2 (g) + O2(g) = 2H2O(l) 的ΔH为:(a+2b-4c-2d)kJ/ mol |
有关能量的判断或表示方法正确的是 ( )
| A.由:H+(aq) + OH-(aq)= H2O(l)△H =-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.3 kJ |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| C.从C(石墨)= C(金刚石)△H =" +" 1.9kJ/mol,可知石墨比金刚石更稳定 |
| D.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)="2" H2O(l)△H =-285.8kJ/mol |
下列热化学方程式或说法正确的是 ( )
| A.甲烷的燃烧热为△H=-890kJ·mol-1,则 |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6kJ?mol-1 2NH3(g)△H=-38.6kJ?mol-1 |
| C.已知:H2(g)+F2(g) = 2HF(g)△H=" —270" kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
强酸与强碱在稀溶液中发生中和反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,向3份同体积0.2 mol ·L-1的NaOH溶液中分别加入适量的稀醋酸、浓硫酸、稀硝酸,恰好完全反应的热效应ΔH1、ΔH2、ΔH3的关系正确的是 ( )
| A.ΔH1>ΔH2>ΔH3 | B.ΔH2>ΔH3>ΔH1 |
| C.ΔH2>ΔH1>ΔH3 | D.ΔH1>ΔH3>ΔH2 |
下列四组选项中,全部符合下图阴影部分的能源分类是 ( )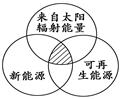
| A.煤炭、石油、沼气 | B.水能、生物能、天然气 |
| C.太阳能、风能、潮汐能 | D.地热能、海洋能、核能 |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是 ( )
A.C(s)+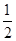 O2(g)=CO(g) ΔH=-393.5 kJ/mol O2(g)=CO(g) ΔH=-393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(g)ΔH=+571.6 kJ/mol |
C.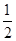 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ/mol |
下列有关热化学方程式的叙述正确的是( )
| A.已知2H2(g)+O2(g)= 2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B.已知C(石墨,s)= C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g) ;△H2。则△H1<△H2 |