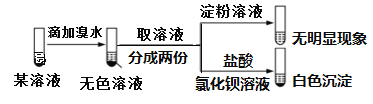
题目内容
【题目】烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
I.采样
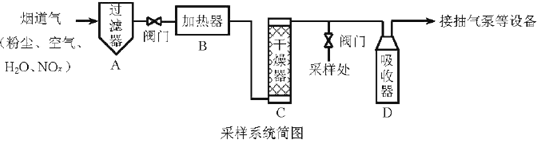
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140。C;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
II. NOx含量的测定
将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3-,加水稀释至100.00 mL。量取20.00 mL该溶液,加入V1 mL c1 mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
(1)NO被H2O2氧化为NO3-的离子方程式是___________。
(2)滴定操作使用的玻璃仪器主要有___________。
(3)滴定过程中发生下列反应:
3Fe2+ +NO3-+4H+ = NO↑+3Fe3+ +2H2O
Cr2O72-+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为_________mg·m-3。
(4)判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若缺少采样步骤③,会使测试结果___________。若FeSO4标准溶液部分变质,会使测定结果___________。
【答案】2NO+3H2O2=2H++2NO3–+2H2O 锥形瓶、酸式滴定管 ![]() 偏低 偏高
偏低 偏高
【解析】
(1)NO与过氧化氢在酸性溶液中发生氧化还原反应生成硝酸和水,反应的离子方程式为:2NO+3H2O2=2H++2NO3–+2H2O;
故答案为:2NO+3H2O2=2H++2NO3–+2H2O;
(2)滴定操作主要用到铁架台、酸式滴定管、锥形瓶、其中玻璃仪器为酸式滴定管、锥形瓶;
故答案为:酸式滴定管、锥形瓶;
(3)滴定剩余Fe2+时,消耗的K2Cr2O7的物质的量为c2V2×103mol,则剩余的Fe2+物质的量为6c2V2×103mol,在所配制溶液中加入的Fe2+物质的量为c1V1×103mol,则与NO3反应的Fe2+物质的量=c1V1×103mol6c2V2×103mol,所以VL气样中氮元素总物质的量![]() ,根据氮元素守恒,二氧化氮的总质量
,根据氮元素守恒,二氧化氮的总质量![]() ,则VL气样中NOx折合成NO2的含量
,则VL气样中NOx折合成NO2的含量![]() ;
;
故答案为:![]() ;
;
(4)若没打开抽气泵,则系统中还存在有气样中的氮元素,导致吸收不完全,测定结果偏低;若FeSO4变质则会导致测定剩余亚铁离子偏低,使计算得到的氮素含量偏高,测定结果偏高;
故答案为:偏低;偏高。

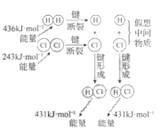
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为_____。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为____(填化学式)。
(3)元素①、③形成的18电子化合物的电子式为____,元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式)。
(4)元素②、⑤形成化合物的电子式为_____。
(5)元素⑤的最高价氧化物对应的水化物的水溶液与元素⑧的最高价氧化物对应水化物反应的离子方程式为