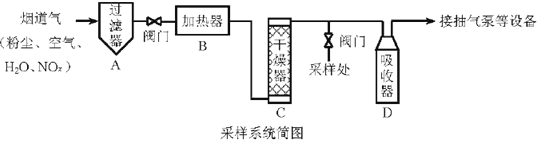
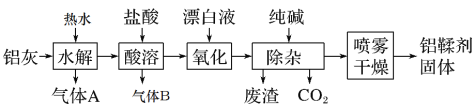
题目内容
【题目】已知:SO32-+I2+H2O→SO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等。现取该溶液进行实验,操作和现象如下。有关该溶液的判断正确的是( )

A.肯定不含I﹣B.可能不含SO42-
C.肯定含有SO32-D.肯定含有NH4+
【答案】C
【解析】
A.由于亚铁离子和铁离子均有颜色,根据实验,向该溶液中滴加溴水,得到无色溶液,一定不含Fe2+,又因为溴水为橙色,碘水为黄色,根据SO32-+I2+H2O→SO42-+2I-+2H+可知,与溴反应的只能是SO32-,若溴水少量,先氧化SO32-,则不能确定是否含I-,故A错误;
B.溶液中一定含有,SO32-,一定不含Fe2+,因为所有离子物质的量浓度相等,阳离子Na+、NH4+、K+,存在其中的两种或三种,若含有SO42-,不能满足电荷守恒,因此一定不存在SO42-,故B错误;
C.由上述分析可知,肯定含有SO32-,故C正确;
D.根据实验不能判断I-是否存在,若阴离子只有SO32-,则含有阳离子为Na+、NH4+、K+中的两种,均可满足电荷守恒,不能确定是否含NH4+,故D错误;
故选C。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】如表中物质间的转化能按如图所示通过一步反应进行的是( )

选项物质 | W | X | Y | Z |
A | Ca | CaO | Ca(OH)2 | CaCO3 |
B | S | SO3 | H2SO4 | CaSO4 |
C | Si | SiO2 | Na2SiO3 | H2SiO3 |
D | Fe | Fe2O3 | FeCl3 | Fe(OH)3 |
A.AB.BC.CD.D
【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是______________(填元素符号)。
(2)③的气态氢化物的电子式______________,②④形成的可溶于水的气态化合物的结构式______________。
(3)这些元素形成的最高价氧化物的水化物中,碱性最强的化合物为______________(填物质的化学式),酸性最强的含氧酸为______________(填物质的化学式)。
【题目】下列实验对应现象及结论有错误的是( )
选项 | 实验 | 现象 | 结论 |
A | 向AgCl悬浊液中加入KI溶液,振荡 | 沉淀由白色变为黄色 | AgCl溶解度大于AgI |
B | 向2mL0.1mol/L的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
C | 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 | 两份溶液均变红,NaHCO3溶液红色更深 | 常温下的水解平衡常数: Kh(CH3COO-)<Kh(HCO3-) |
D | 常温时,用两支试管各取4mL 0.1mol/L 酸性KMnO4溶液,分别加入0.1mol/L和0.2 mol/L H2C2O4溶液各2 mL | 两试管溶液均褪色,且加0.2mol/L H2C2O4 溶液的试管中褪色更快 | 其它条件不变,H2C2O4溶液的浓度越大,化学反应速率越大 |
A. AB. BC. CD. D