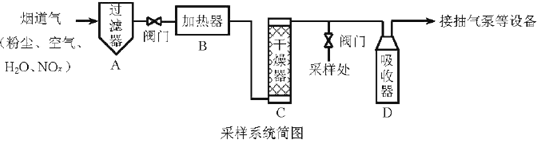
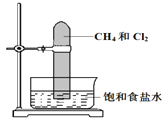
题目内容
【题目】同温同压下,甲容器中充满35Cl2,乙容器中充满37Cl2,下列叙述不正确的是
A. 若两种气体体积相等,甲、乙两容器中气体的密度之比为35∶37
B. 若两种气体体积相等,甲、乙两容器中气体分子数之比为35∶37
C. 若两种气体质量相等,甲、乙两容器中气体所含质子数之比为37∶35
D. 若两种气体体积相等,甲、乙两容器中气体所含中子数之比为9∶10
【答案】B
【解析】
35Cl2的相对分子质量为70,37Cl2的相对分子质量为74。
A.同温同压下,若两种气体体积相等,由n=![]() =
=![]() 可得ρ=
可得ρ=![]() =
=![]() ,密度与摩尔质量呈正比,甲、乙两容器中气体的密度之比为35∶37,故A正确;
,密度与摩尔质量呈正比,甲、乙两容器中气体的密度之比为35∶37,故A正确;
B.同温同压下,由n=![]() =
=![]() 可知体积与分子数呈正比,若两种气体体积相等,则甲、乙两容器中气体分子数之比为1∶1,故B错误;
可知体积与分子数呈正比,若两种气体体积相等,则甲、乙两容器中气体分子数之比为1∶1,故B错误;
C.若两种气体质量相等,由n=![]() 可知,气体的物质的量与摩尔质量呈反比,则甲、乙两容器中气体的物质的量之比为37∶35,因都由Cl元素组成,则所含质子数之比为37∶35,故C正确;
可知,气体的物质的量与摩尔质量呈反比,则甲、乙两容器中气体的物质的量之比为37∶35,因都由Cl元素组成,则所含质子数之比为37∶35,故C正确;
D.同温同压下,若两种气体体积相等,则两种容器的气体的物质的量相等,甲、乙两容器中气体所含中子数之比为(3517)×2∶(3717)×2=9∶10,故D正确;
答案选B。

练习册系列答案
相关题目
【题目】如表中物质间的转化能按如图所示通过一步反应进行的是( )
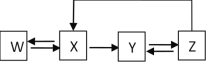
选项物质 | W | X | Y | Z |
A | Ca | CaO | Ca(OH)2 | CaCO3 |
B | S | SO3 | H2SO4 | CaSO4 |
C | Si | SiO2 | Na2SiO3 | H2SiO3 |
D | Fe | Fe2O3 | FeCl3 | Fe(OH)3 |
A.AB.BC.CD.D