题目内容
6.根据甲酸分子的结构,预测甲酸可能具有的三种化学性质,并任选其中两种设计实验证实你的预测,简要写出实验方案.化学性质①酸性,实验方案用玻璃棒蘸甲酸溶液点在pH试纸上,并与标准比色卡对比,常温下使新制的Cu(OH)2悬浊液溶解
化学性质②还原性,实验方案加热至沸使新制的蓝色絮状Cu(OH)2转化成红色沉淀
化学性质③氧化性.
分析 甲酸的结构如图所示: ,含有醛基、羰基、羧基和羟基.含有-CHO和-COOH两种官能团,预测甲酸可能具有的三种化学性质①具有酸性:用玻璃棒蘸甲酸溶液点在pH试纸上,并与标准比色卡对比;或:常温下使新制的Cu(OH)2悬浊液溶解为酸性;
,含有醛基、羰基、羧基和羟基.含有-CHO和-COOH两种官能团,预测甲酸可能具有的三种化学性质①具有酸性:用玻璃棒蘸甲酸溶液点在pH试纸上,并与标准比色卡对比;或:常温下使新制的Cu(OH)2悬浊液溶解为酸性;
②具有还原性:在试管里加入约2 mL新制的Cu(OH)2浊液,振荡后加入少量甲酸溶液,加热至沸腾,观察现象;
③具有氧化性:能和氢气发生加成反应.
解答 解:甲酸的结构如图所示: ,含有醛基、羰基、羧基和羟基.含有-CHO和-COOH两种官能团,预测甲酸可能具有的三种化学性质:-COOH具有酸性;-CHO能被氧化成羧基,具有还原性,-CHO能和氢气加成成醇,被还原;
,含有醛基、羰基、羧基和羟基.含有-CHO和-COOH两种官能团,预测甲酸可能具有的三种化学性质:-COOH具有酸性;-CHO能被氧化成羧基,具有还原性,-CHO能和氢气加成成醇,被还原;
①-COOH具有酸性;酸溶液的PH<7,可用玻璃棒蘸甲酸溶液点在pH试纸上,并与标准比色卡对比,酸和碱能发生中和反应生成盐和水,也可用常温下使新制的Cu(OH)2悬浊液,Cu(OH)2悬浊液溶解,说明甲酸为酸性,
故答案为:酸性;用玻璃棒蘸甲酸溶液点在pH试纸上,并与标准比色卡对比;或:常温下使新制的Cu(OH)2悬浊液溶解为酸性;
②;-CHO具有还原性,能被新制的氢氧化铜氧化,与新制蓝色絮状Cu(OH)2悬浊液共热反应生成砖红色沉淀,
故答案为:还原性;加热至沸使新制的蓝色絮状Cu(OH)2转化成红色沉淀;
③有机反应加氧脱氢为氧化反应,加氢脱氧为还原反应,-CHO能和氢气加成成醇,被还原,甲酸具有氧化性,
故答案为:氧化性.
点评 本题考查甲酸分子的结构探究实验方案的设计,掌握甲酸含有醛基、羰基、羧基和羟基.含有-CHO和-COOH两种官能团为解答关键,该题有利于培养学生的学习兴趣,激发学生学习化学的积极性.注意甲酸只体现醛基和羧基的性质,题目难度中等.

练习册系列答案
相关题目
1.某同学做同周期元素性质递变规律实验时,设计了实验方案,并记录了如下.
请你帮助该同学整理并完成实验报告
(1)实验目的::探究同周期元素的金属性和非金属性的递变规律.
(2)实验内容:(填写与实验方案相对应的实验现象)
①E②A③C④B⑤D
(3)实验结论:同周期元素,从左到右,元素金属性逐渐减弱.
| 实验方案 | 实验现象 |
| ①将镁带用砂纸擦后,放入试管中,加入少量水后,加热至水沸腾;再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,四处游动,发出“嘶嘶”声,随之消失,溶液变红色 |
| ②将一小块金属钠放入滴有酚酞试液的冷水反应 | (B)反应不十分剧烈,产生的气体可在空气中燃烧 |
| ③镁带与2mol/L的稀盐酸反应 | (C)剧烈反应,产生的气体可在空气中燃烧 |
| ④铝条与2mol/L的稀盐酸反应 | (D)生成白色胶状沉淀,继而沉淀消失 |
| ⑤向AlCl3溶液滴加NaOH溶液 | (E)产生大量气体,可在空气中燃烧,溶液变红色 |
(1)实验目的::探究同周期元素的金属性和非金属性的递变规律.
(2)实验内容:(填写与实验方案相对应的实验现象)
①E②A③C④B⑤D
(3)实验结论:同周期元素,从左到右,元素金属性逐渐减弱.
15.下列各组中的两种物质熔化时克服的作用力不同的是( )
| A. | 干冰、SO3晶体 | B. | 食盐、烧碱 | ||
| C. | 氧化镁、冰 | D. | 固态氮气、固态氧气 |
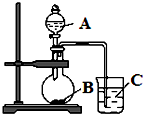 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.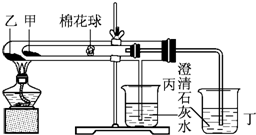 下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题:
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题: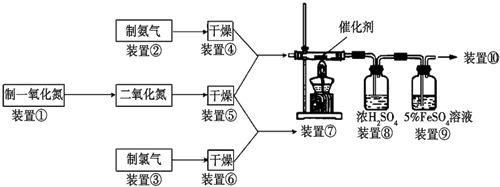

 ;②中离子方程式为Br-+Ag+═AgBr↓;
;②中离子方程式为Br-+Ag+═AgBr↓;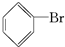 、Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤,洗涤后分离粗产品应使用的仪器是分液漏斗;
、Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤,洗涤后分离粗产品应使用的仪器是分液漏斗; ;
;