题目内容
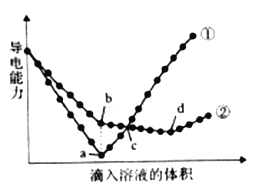
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液。其导电能力随滴入溶液体积变化的曲线如下图所示。请回答下列问题。
(1)写出NaHSO4溶液中,NaHSO4的电离方程式____________________。
(2)图中①、②分别代表滴加哪种溶液的变化曲线①_______、②______。
(3)b点,溶液中大量存在的离子是_________。
(4)曲线②中d点导电能力最弱的原因是____________________ (用化学方程式表示)。
(5)c点,两溶液中含有相同量的哪种离子______。
【答案】NaHSO4=Na++H++SO42- H2SO4 NaHSO4 Na+、OH- Ba(OH)2+2NaHSO4=BaSO4↓+Na2SO4+2H2O SO42-
【解析】
Ba(OH)2溶液和H2SO4、NaHSO4溶液反应方程式分别为H2SO4+Ba(OH)2=BaSO4↓+2H2O、NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,溶液导电能力与溶液中离子浓度成正比,根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应,根据图知,a点为Ba(OH)2溶液和H2SO4恰好反应,H2SO4、NaHSO4溶液的物质的量浓度相等,则b点溶液溶质为NaOH;c点,①中稀硫酸过量,溶质为H2SO4,②中反应后溶质为NaOH、Na2SO4;a点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水;d点②中溶质为Na2SO4。
根据上述分析可知:曲线①为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应;a点为Ba(OH)2溶液和H2SO4恰好反应;b点溶液溶质为NaOH;c点,①中稀硫酸过量,溶质为H2SO4,②中反应后溶质为NaOH、Na2SO4; d点②中溶质为Na2SO4。
(1)NaHSO4是强电解质,该溶液中,NaHSO4的电离方程式为NaHSO4=Na++H++SO42-;
(2)根据上述分析可知:曲线①为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应;;
(3)a点为Ba(OH)2溶液和H2SO4恰好反应,H2SO4、NaHSO4溶液的物质的量浓度相等,则b点溶液溶质为NaOH。NaOH是强电解质,完全电离,因此溶液中含有的大量离子是Na+、OH-;
(4)d点②中溶质为Na2SO4,此时发生反应:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,溶液中自由移动的离子浓度越大,溶液的导电性越强,d点自由移动离子浓度最小,所以导电能力最弱;
(5)c点,①中稀硫酸过量,溶质为H2SO4,②中反应后溶质为NaOH、Na2SO4,由于此时滴入的是等体积的物质的量浓度相等的H2SO4、NaHSO4溶液,所以两溶液中含有相同量的SO42-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案





