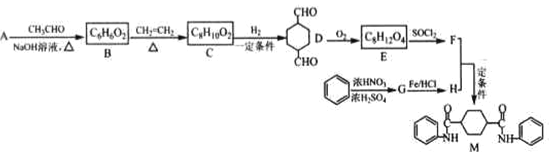
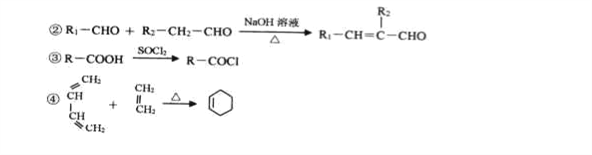
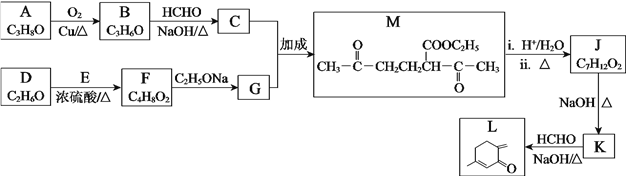
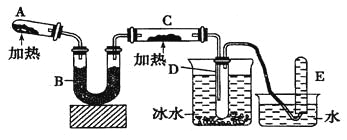
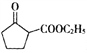
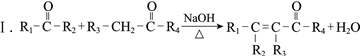题目内容
【题目】水体污染的治理是化学工作者研究的重要课题。
(1)水体常见污染物之一的氨氮主要指游离氨或铵盐,可以通入一定量的氯气,利用产生的HC1O除去。
已知:NH4++HClO=NH2Cl+H++H2O △H=akJ/mol
2NH2Cl+HClO=N2+H2O+3H++3Cl- △H=bkJ/mol
NH4++4HClO=NO3-+6H++4Cl-+H2O △H=ckJ/mol
则2NH4++3HClO=N2+3H2O+5H++3Cl- △H=______kJ/mol
(2)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来模拟。
①电解时,阳极的电极反应式为______________。电解过程中溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示:

②图l中当Cl-浓度较低时、图2中当初始pH达到12时,氨氮去除速率低而能耗高的原因可能是_______________________。
③图2中,pH为____时处理效果最佳;当pH过低时,处理效果不佳的原因可能是_______。
(3)废水中的重金属离子通常用沉淀法除去。已知Ksp(NiS) =1.1×l0-21.Ksp(CuS)=1.3×10-36,国家规定的排放标准:镍低于1.1×10-5mol/L,铜低于7.8×l0-5mol/L。则需要控制溶液中S2-的浓度不低于______mol/L。
【答案】 2a+b 2Cl﹣﹣2e﹣=Cl2↑ 阳极可能OH﹣放电,产生大量氧气,消耗电能 6 pH太低时,产生的Cl2会从溶液中逸出 10﹣16
【解析】(1)设已知中的三个方程式分别为①、②、③,2×①+②得:2NH4++3HClO=N2+3H2O+5H++3Cl-,故ΔH=(2a+b)kJ mol-1。
(2)①用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液,阳极发生氧化反应,Cl-失电子生成氯气,电极反应式为:2Cl--2e-=Cl2↑。②Cl-浓度较低或pH较大时,阳极可能是OH-放电,产生大量氧气,消耗电能,所以氨氮去除速率低而能耗高。③由图像可看出,图2中pH为6时处理效果最佳;pH过低时,氢离子浓度大,反应Cl2+H2O![]() H++Cl-+HClO平衡逆向移动,Cl2溶解度降低,产生的Cl2会从溶液中逸出而使氨氮去除速率降低,所以处理效果不佳。
H++Cl-+HClO平衡逆向移动,Cl2溶解度降低,产生的Cl2会从溶液中逸出而使氨氮去除速率降低,所以处理效果不佳。
(3)Ni2+达到排放标准时,c(S2-)×c(Ni2+)≤Ksp(NiS),所以c(S2-)≥ mol/L=
mol/L=![]() =10-16mol/L,因为Ksp(CuS)远小于Ksp(NiS),所以此时Cu2+肯定达到排放标准,则需要控制溶液中S2-的浓度不低于10-16mol/L。
=10-16mol/L,因为Ksp(CuS)远小于Ksp(NiS),所以此时Cu2+肯定达到排放标准,则需要控制溶液中S2-的浓度不低于10-16mol/L。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案