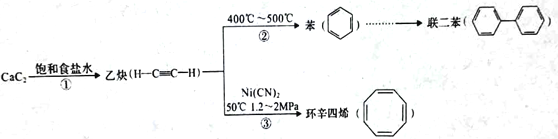
题目内容
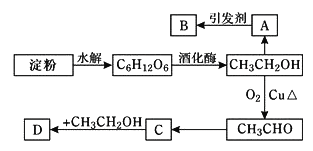
【题目】根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关反应的化学方程式:
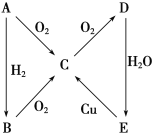
(1)当A为气体单质时:A是_______,B是_______,C是________,D是________,E是________;E→C的离子方程式是______________________________________B→C的化学方程式是__________________________________。
(2)当A为固体单质时:A是______,B是______,C是_______,D是_______,E是______;E→C的化学方程式是______________________________________
【答案】N2 NH3 NO NO2 HNO3 3Cu+8H+(稀) +2NO3- ===3Cu2++2NO↑+4H2O 4NH3+5O2![]() 4NO+6H2O S H2S SO2 SO3 H2SO4 Cu+2H2SO4(浓)
4NO+6H2O S H2S SO2 SO3 H2SO4 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
【解析】
根据硫及其化合物的转化关系分析解答;根据氮及其化合物的转化关系分析解答。
(1) 当A是气体单质时,A能被氧化生成C、C能继续被氧化生成D、D和水反应生成E,E能和Cu反应生成C,则E应该是硝酸,A是N2,C是NO,D是NO2,E是硝酸, A能和氢气反应生成氢化物B,所以B是NH3;
E生成C的化学方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,离子反应方程式为:3Cu+8H+(稀) +2NO3- ===3Cu2++2NO↑+4H2O;
B到C的反应是氨气与氧气反应,方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
故答案为:N2;NH3;NO;NO2;HNO3;3Cu+8H+(稀) +2NO3- ===3Cu2++2NO↑+4H2O;4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2) 当A为固体单质时,A能连续被氧化生成D,D和水反应生成E,E和铜反应生成C,能和Cu反应的酸除了硝酸我们还学过硫酸,所以E是硫酸,则A是S,B是H2S,C是SO2,D是SO3, E生成C的方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
故答案为:S;H2S;SO2;SO3;H2SO4;Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】某学生用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作如下: ①用标准溶液润洗滴定管2-3 次,取标准NaOH 溶液注入碱式滴定管至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“0”或“0”刻度线稍下,并记下读数;④量取20.00mL待测液注入清净的锥形瓶中,并加入3滴酚酞溶液;⑤用标准液滴定至终点,记下滴定管液面读数;⑥重复以上滴定操作2-3 次。
请回答下列问题:
(1)步骤④中,若在取盐酸的滴定管尖嘴部分有气泡且取液结束前气泡消失,则测定结果____(填“偏大”、“偏小”或“无景响”)。
(2)判断到达滴定路点的依据是____________。
(3)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 21.10 |
2 | 20.00 | 0.00 | 19.40 |
3 | 20.00 | 0.00 | 19.32 |
以上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是__________
A.NaOH 标准液保存时间过长,有部分变质
B.锥形瓶用待测液润洗
C.配制NaOH 标准液所用的药品中混有KOH固体
D.滴定结束时,俯视读数
(4)根据上表记录数据,通过计算可得,该盐酸浓度为_____mol/L。
(5)室温下,用0.100mol/LNaOH溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是_________
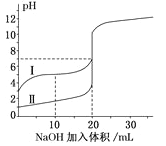
A.V(NaOH)=20mL时,c(Cl-)=c(CH3COO-)
B.I表示的是滴定盐酸的曲线
c.pH=7时,滴定醋酸消耗V(NaOH)小于20mL
D.V(NaOH)=10mL时,醋酸溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
【题目】除去下列括号内的杂质,所加试剂和操作均正确的是
选项 | 需除杂的物质 | 试剂 | 操作 |
A | Cl2(HCl) | 饱和食盐水 | 洗气 |
B | NaBr溶液(NaI) | Cl2 | 洗气 |
C | Cl2(H2O) | 碱石灰(CaO和NaOH) | 洗气 |
D | 铁粉(铝粉) | 稀硫酸 | 过滤 |
A.AB.BC.CD.D