题目内容
相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g) + O2(g)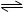 2SO3(g) + 197 kJ实验测得有关数据如下:
2SO3(g) + 197 kJ实验测得有关数据如下:
| 容器编号 | 起始时各物质的物质的量 / mol | 达到平衡时体系能量的变化/KJ | ||
| SO2 | O2 | SO3 | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
下列判断中不正确的是
A.197>Q1>Q2
B.达到平衡时SO2的体积分数:甲>乙
C.两容器中反应的平衡常数相等
D.生成1molSO3(l)时放出的热量大于98.5kJ
B
解析试题分析:A中甲是由正反应方向建立平衡,由于是可逆反应不能完全转化,故197>Q1。乙中平衡是从正反两方向进行建立的,放出热量必然存在Q1>Q2,A正确;B.两都是等效平衡达到平衡时SO2的体积分数甲=乙,不考虑温度变化,错误;平衡常数只与温度有关,温度相同必然相等,正确; D中若生成1molSO3(g)时放出的热量等于于98.5kJ,但由气态到液态时还要放出热量,故生成1molSO3(l)时放出的热量大于98.5kJ,正确。
考点:本题考查了化学平衡的移动,平衡常数的概念等知识。

反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为 ( )
2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为 ( )
| A.0.1 s | B.2.5 s | C.5 s | D.10 s |
某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | | 无 |
| ③ | 10 mL 5% H2O2溶液 | MnO2固体 |
A.5 mL 2% H2O2溶液 B.10 mL 5% H2O2溶液
C.10 mL 2% H2O2溶液 D.5 mL 10% H2O2溶液
T℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为Tl和T2时,Y的体积分数 (Y)与时间的关系如图2所示。则下列结论错误的是
(Y)与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.反应进行的前4min内,用X表示的反应速率v(X)=0.15mo1?(L?min)—1 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
下列事实不能用勒夏特列原理解释的是
| A.热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好 |
| B.配制FeCl3溶液时,在溶液中加入少量稀盐酸 |
| C.等质量粉末状与块状碳酸钙分别与同浓度的盐酸反应,粉末状比块状的反应快 |
| D.新制的氯水在光照条件下颜色变浅 |
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g) 2C(g) ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确的是
2C(g) ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确的是
| A.若P1>P2,纵坐标表示A的质量分数 |
| B.若P1<P2,纵坐标表示C的质量分数 |
| C.若P1>P2,纵坐标表示混合气体的平均摩尔质量 |
| D.若P1<P2,纵坐标表示A的转化率 |
在密闭容器中存在下列平衡:CO(g)+H2O(g)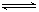 CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是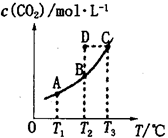
| A.平衡状态A与C相比,平衡状态A的c(CO)小 |
| B.在T2时,若反应处于状态D,则一定有v正<v逆 |
C.反应CO(g)+H2O(g)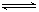 CO2(g)+H2(g)△H>0 CO2(g)+H2(g)△H>0 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:
甲:a(g)+b(g)  2c(g) ΔH1<0、 乙: x(g)+3y(g)
2c(g) ΔH1<0、 乙: x(g)+3y(g)  2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是( )
| A.绝热下向甲中通入惰性气体,c的物质的量不变 |
| B.绝热下向乙中通入z气体,反应器中温度升高 |
| C.恒温下向甲中通入惰性气体,甲中平衡不移动,乙中X、Y的转化率增大 |
| D.恒温下向乙中通入z气体,y的物质的量浓度增大 |
 2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:
2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法: