题目内容
下列事实不能用勒夏特列原理解释的是
| A.热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好 |
| B.配制FeCl3溶液时,在溶液中加入少量稀盐酸 |
| C.等质量粉末状与块状碳酸钙分别与同浓度的盐酸反应,粉末状比块状的反应快 |
| D.新制的氯水在光照条件下颜色变浅 |
C
解析试题分析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,中这就是勒夏特列原理,该原理适用于所有的平衡体系。A、碳酸钠水解溶液显碱性,可以用去除油污。水解吸热,因此热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好,适用于勒夏特列原理,A不正确;B、铁离子水解溶液显酸性,所以配制FeCl3溶液时,在溶液中加入少量稀盐酸可以抑制铁离子的水解,适用于勒夏特列原理,B不正确;C、固体反应物的接触面积越大,反应速率越快,与勒夏特列原理无关,C正确;D、在氯水中存在平衡Cl2+H2O HClO+HCl,光照促进次氯酸分解,有利于平衡向正反应方向移动,所以新制的氯水在光照条件下颜色变浅,适用于勒夏特列原理,D不正确,答案选C。
HClO+HCl,光照促进次氯酸分解,有利于平衡向正反应方向移动,所以新制的氯水在光照条件下颜色变浅,适用于勒夏特列原理,D不正确,答案选C。
考点:考查勒夏特列原理的应用与判断

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
下列反应达到化学平衡后,加压或升温都能使化学平衡向逆反应方向移动的是
A.SO2(g)+NO2(g)  SO3(g)+NO(g) ΔH<0 SO3(g)+NO(g) ΔH<0 |
B.C(s)+CO2(g)  2CO(g)ΔH>0 2CO(g)ΔH>0 |
C.4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH<0 4NO(g)+6H2O(g)ΔH<0 |
D.H2S(g)  H2(g)+S(s)ΔH>0 H2(g)+S(s)ΔH>0 |
下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是
| A.K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了 |
| B.比较Ksp与离子积Qc的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解 |
| C.K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大 |
| D.弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka ·Kh |
一定条件下,向密闭容器中加入X物质发生反应:3X(g)  Y(g) + Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
Y(g) + Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
| 反应时间(min) | 0 | 5 | 15 | 17 | 20 |
| X的浓度(mol·L-1) | 1.0 | 0.4 | 0.4 | 0.7 | 0.7 |
B.5 min时反应达到平衡,该温度下的平衡常数值为0.625
C.15 min时改变的条件可能是降低温度
D.从初始到18 min时,X的转化率为30 %
相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g) + O2(g) 2SO3(g) + 197 kJ实验测得有关数据如下:
2SO3(g) + 197 kJ实验测得有关数据如下:
| 容器编号 | 起始时各物质的物质的量 / mol | 达到平衡时体系能量的变化/KJ | ||
| SO2 | O2 | SO3 | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
下列判断中不正确的是
A.197>Q1>Q2
B.达到平衡时SO2的体积分数:甲>乙
C.两容器中反应的平衡常数相等
D.生成1molSO3(l)时放出的热量大于98.5kJ

 A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是 C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是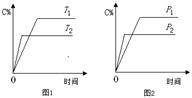
 pC(g)+qD(g) △H<0。下列结论中错误的是
pC(g)+qD(g) △H<0。下列结论中错误的是