题目内容
在25℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图: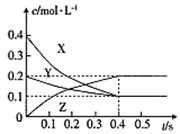
下列说法错误的是( )
A.反应可表示为3X+Y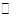 2Z 2Z |
| B.从反应开始到0.4s时,以Y表示的化学反应速率为:0.25mol·L-1·s-1 |
| C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D.升高温度,平衡常数可能增大也可能减小 |
B
解析试题分析:A、首先可以看出Y减少0.1,X减少0.3,Z增加0.2,可以得出方程式为3X+Y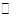 2Z,正确; B、从反应开始到0.4s时,Y的浓度变化量为0.1mol·L-1,Y表示的化学反应速率为0.25mol·L-1·s-1正确;C、平衡常数只受温度影响,错误; D、由于反应的△H正负无法确定,升高温度,平衡常数可能增大也可能减小,正确。
2Z,正确; B、从反应开始到0.4s时,Y的浓度变化量为0.1mol·L-1,Y表示的化学反应速率为0.25mol·L-1·s-1正确;C、平衡常数只受温度影响,错误; D、由于反应的△H正负无法确定,升高温度,平衡常数可能增大也可能减小,正确。
考点:考查化学反应速率与化学平衡移动相关知识。

铁的氧化物可用于脱除煤气中的H2S,该反应原理为:
①Fe3O4 (s)+3H2S(g)+H2 (g) 3FcS(s)+4H2O(g) △H=a kJ ? mol-1
3FcS(s)+4H2O(g) △H=a kJ ? mol-1
②Fe2O3(s)+2H2S(g) + H2(g) 2FeS(s)+3H2O(g) △H=bkJ ? mol-1
2FeS(s)+3H2O(g) △H=bkJ ? mol-1
③FeO(s)+H2S(g)  FeS(s)+H2O(g) △H=ckJ· mol-1
FeS(s)+H2O(g) △H=ckJ· mol-1
温度与平衡常数的关系如图,下列有关说法正确的是
| A.a、b、c均小于0 |
| B.压强越大,H2S的脱除率越高 |
| C.温度越高,H2S的脱除率越高 |
| D.反应①、②、③的平衡常数表达式相同 |
下列图示与对应的叙述相符的是 ( )
图1 图2 图3 图4
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正 > v逆 |
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
下列说法正确的是( )
| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
B.25℃时反应Ni(CO)4(g)  Ni(s)+4CO(g)的平衡常数为0.5(mol·L-1)3 Ni(s)+4CO(g)的平衡常数为0.5(mol·L-1)3 |
| C.在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol/L,则此时温度高于80℃ |
| D.80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,再次达到平衡后CO的体积分数减小 |
已知反应A(g)+3B(g)  2C(g)+D(g),在某段时间内,以A的浓度变化表示的反应速率为2 mol/(L·s),则以C的浓度变化表示的反应速率为
2C(g)+D(g),在某段时间内,以A的浓度变化表示的反应速率为2 mol/(L·s),则以C的浓度变化表示的反应速率为
| A.1 mol/(L·s) | B.3 mol/(L·s) |
| C.4 tool/(L·s) | D.2 mol/(L·s) |
下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是
| A.10℃ 20mL 3mol/L的盐酸溶液 | B.20℃ 30mL 2mol/L的盐酸溶液 |
| C.20℃ 20mL 2mol/L的盐酸溶液 | D.20℃ 10mL 4mol/L的盐酸溶液 |
下图是可逆反应X2+3Y2 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
| A.t1时,只有正方向反应 | B.t1~t2时,X2的物质的量越来越多 |
| C.t2~t3,反应不再发生 | D.t2~t3,各物质的浓度不再发生变化 |
工业生产硫酸时,其中一步反应是2SO2 + O2 2SO3,该反应正反应是放热反应,下列说法不正确的是( )
2SO3,该反应正反应是放热反应,下列说法不正确的是( )
| A.升高温度可提高反应速率 |
| B.使用催化剂能增大反应速率 |
| C.增大氧气浓度可提高SO2的转化率 |
| D.达到化学平衡时正逆反应速率相等且都为零 |
 2C(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
2C(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )