题目内容
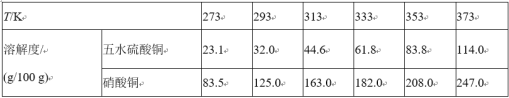
【题目】A是一种红棕色金属氧化物,B、G是金属单质,F是一种难溶于水的白色化合物,受热后容易发生分解。
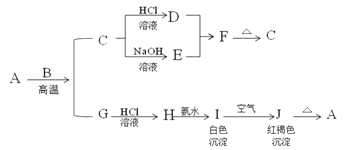
(1)写出下列物质的化学式:A:___ E:___ F:___ H:__。
(2)按要求写方程式:
①H与氨水反应的离子方程式:___。
②B与氢氧化钠溶液反应的离子方程式:___。
③I在空气中转化为J的化学方程式:___。
【答案】Fe2O3 NaAlO2 Al(OH)3 FeCl2 Fe2+ +2NH3·H2O=Fe(OH)2↓+2NH4+ 2Al+2OH-+2H2O=2AlO2-+3H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
A是一种红棕色金属氧化物,所以是三氧化二铁,和金属B在高温下发生铝热反应,生成的C为铝的氧化物,既能和酸反应又能和碱反应,白色沉淀在空气中变成红褐色沉淀,一定是氢氧化亚铁和氢氧化铁之间的转换,所以J是氢氧化铁,I是氢氧化亚铁,根据物质的性质可推断得,H是氯化亚铁,G是金属铁,F是一种难溶于水的白色化合物为氢氧化铝,则金属B是铝,D是氯化铝,E是偏铝酸钠,根据铁及化合物以及铝及化合物的有关性质来回答.
(1)根据分析可知A为Fe2O3;E为NaAlO2;F为Al(OH)3;H为FeCl2,
故答案为:Fe2O3;NaAlO2; Al(OH)3;FeCl2;
(2)①FeCl2与氨水反应的离子方程式为Fe2+ +2NH3·H2O=Fe(OH)2↓+2NH4+;
②铝与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
③氢氧化亚铁在空气中转化为氢氧化铁的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:Fe2+ +2NH3·H2O=Fe(OH)2↓+2NH4+;2Al+2OH-+2H2O=2AlO2-+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3

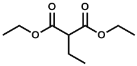
【题目】将![]() 和
和![]() 以
以![]() (体积比)分别通入到体积为2L的恒容密闭容器中进行反应:
(体积比)分别通入到体积为2L的恒容密闭容器中进行反应:![]() ,得到如下三组数据,其中实验①、②没有使用催化剂。下列说法不正确的是( )
,得到如下三组数据,其中实验①、②没有使用催化剂。下列说法不正确的是( )
实验 | 温度/℃ | 起始 | 平衡 | 达平衡所需时间/min |
① | 500 | 5.00 | 2.00 | 40 |
② | 800 | 3.00 | 1.00 | 15 |
③ | 500 | 3.00 | 1.20 | 9 |
A. 实验①中,在![]() 内,以
内,以![]() 表示的反应速率大于
表示的反应速率大于![]()
B. 比较实验①和②,不能说明浓度对反应速率的影响
C. 比较实验①和②,不能说明反应速率随温度升高而增大
D. 比较实验②和③,说明实验③使用了催化剂