��Ŀ����
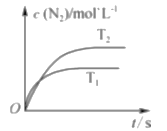
����Ŀ����1�����ڷ�Ӧ2SiHCl3(g)===SiH2Cl2(g)��SiCl4(g)�����ô�������������ӽ�����֬��������323 K��343 KʱSiHCl3��ת������ʱ��仯�Ľ����ͼ��ʾ��

��343 Kʱ��Ӧ��ƽ��ת��������________%��ƽ�ⳣ��K343 K��________(����2λС��)��
����343 K�£�Ҫ���SiHCl3ת���ʣ��ɲ�ȡ�Ĵ�ʩ��________��Ҫ���̷�Ӧ�ﵽƽ���ʱ�䣬�ɲ�ȡ�Ĵ�ʩ��________��________��
���Ƚ�a��b����Ӧ���ʴ�С��va________vb(������������С��������������)����Ӧ����v��v����v����k��x2SiHCl3��k��xSiH2Cl2xSiCl4��k����k���ֱ�Ϊ��������Ӧ���ʳ�����xΪ���ʵ�������������a����v��/v����________(����1λС��)��
��2����ͬ�¶���ˮ�����ӻ����������ʾ��
t/�� | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
���������ֽ������¶�����ˮ�����ӻ������ԭ��_______________��
��10��ʱ��ˮ�ĵ���ƽ�ⳣ��Ϊ_________������100��ʱ��ˮ�е��������������Ũ��Ϊ__________________��
���𰸡�22 0.02 ��ʱ��ȥ���� �Ľ����� ��߷�Ӧ��ѹǿ(Ũ��) ���� 1.3 ˮ�������ȣ������¶ȵ���ƽ������ 5.3��10-17 7.4��10-7mol/L
��������
��1�������ڷ�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����ƣ��ɷ�Ӧ��ƽ�ⳣ��K= c(SiH2Cl2)c(SiCl4)/c2(SiHCl3)���㣻
����÷�ӦΪ���������������ȷ�Ӧ����С������Ũ�ȣ�ƽ�����ƣ�����Ӧ��Ũ�Ȼ�����ѹǿ��ʹ�ú��ʵĴ����ȴ�ʩ�ܼӿ췴Ӧ���ʣ����̴ﵽƽ���ʱ�䣻
�۷�Ӧ�¶�Խ�ߣ���ѧ��Ӧ����Խ�죻��K=K��/K��=0.02������a��SiHCl3ת����Ϊ20%��������ʵ����ʵ�������������ɹ�ʽ����v��/v����
��2����ˮ�ĵ��������ȷ�Ӧ�������¶ȴٽ����룻
��һ���¶��£���ˮ�ĵ���ƽ�ⳣ��Ka=Kw/55.6mol/L����ˮ�е��������������Ũ��c(H+)=![]() ��
��
��1�������ڷ�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����ƣ�SiHCl3ת����������aΪ343Kʱ��ת�������ߣ�bΪ323Kʱ��ת�������ߣ���ͼ��֪343Kʱ��SiHCl3ת����Ϊ22%������ʼSiHCl3��Ũ��Ϊx����ƽ��ʱSiHCl3��Ũ��Ϊ0.78x��SiH2Cl2��SiCl4��Ũ�Ⱦ�Ϊ0.11x���ʷ�Ӧ��ƽ�ⳣ��K= c(SiH2Cl2)c(SiCl4)/c2(SiHCl3)=��0.11x������0.11x��/(0.78x)2��0.02���ʴ�Ϊ��22��0.02��
����÷�ӦΪ���������������ȷ�Ӧ������343K�£����SiHCl3ת���ʵĴ�ʩΪ��ʱ��ȥ�����С�������Ũ�ȣ����̴ﵽƽ���ʱ�䣬���Բ�ȡ����Ӧ��Ũ�ȡ�����ѹǿ��ʹ�ú��ʵĴ����ȴ�ʩ���ʴ�Ϊ����ʱ��ȥ�������Ӧ��Ũ�Ȼ�����ѹǿ��ʹ�ú��ʵĴ�����
��a��ķ�Ӧ�¶ȸ���b�㣬�¶�Խ�߷�Ӧ����Խ�죬a��ķ�Ӧ���������b�㣻�ɻ�ѧƽ�ⳣ����֪��K��/K��=0.02����a��SiHCl3ת����Ϊ20%���ɵ�SiHCl3��SiH2Cl2��SiCl4�����ʵ����ֱ�Ϊ0.8x��0.1x��0.1x�����ʵ��������ֱ�Ϊ80%��10%��10%����v��/v��=0.02�� 64��1.3���ʴ�Ϊ�����ڣ�1.3��
��2����ˮ�ĵ��������ȷ�Ӧ�������¶ȴٽ����룬����ˮ�����ӻ����������¶ȵ����߶����ʴ�Ϊ��ˮ�������ȣ������¶Ⱥ�ƽ�������ƶ���
��1Lˮ�����ʵ���=1000g/18g/mol=55.6mol��10��ʱ��ˮ�ĵ���ƽ�ⳣ��Ka=Kw/55.6mol/L
=(0.292��10-14)/55.6=5.3��10-17��100��ʱ��ˮ�е��������������Ũ��c(H+)=![]() =
=![]() =7.4��10-7mol/L���ʴ�Ϊ��5.3��10-17��7.4��10-7mol/L��
=7.4��10-7mol/L���ʴ�Ϊ��5.3��10-17��7.4��10-7mol/L��

����Ŀ��A��B��C����ǿ����ʣ�������ˮ�е�������������±���ʾ��
������ | Na����K����Cu2�� |
������ | SO42-��OH�� |
��ͼ1��ʾװ���У��ס��ҡ��������ձ�������ʢ��������A��Һ��������B��Һ��������C��Һ���缫��Ϊʯī�缫����ͨ��Դ������һ��ʱ��������c�缫����������16 g�������¸��ձ�����Һ��pH����ʱ��t�Ĺ�ϵ��ͼ2��ʾ����ش��������⣺
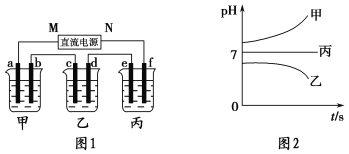
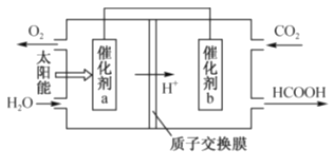
��1��MΪֱ����Դ��________����b�缫�Ϸ����ĵ缫��ӦΪ______________________��
��2������e�缫�����ɵ������ڱ�״���µ����Ϊ________________��
��3��д�����ձ��е��ܷ�Ӧ����ʽ��____________________________________________��
����Ŀ���Ի�����Ϊԭ��������������������к�Fe2O3��SiO2��Al2O3��CaO��MgO�ȡ������������Ʊ�����(Fe2O3)���������£�
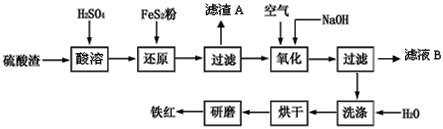
��1�����ܹ�����Fe2O3��ϡ���ᷴӦ�����ӷ���ʽ��____��
��2����ԭ�����м���FeS2�ǽ���Һ�е�Fe3+ ��ԭΪFe2+��������������ΪSO42����д���йص����ӷ���ʽ��_____��
��3�����������У�Ϊ��ȷ�����������������������Ҫ������Һ��pH�ķ�Χ��__��
������������������������ʽ����ʱ��Һ��pH������
������ | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
��ʼ���� | 2.7 | 3.8 | 7.5 | 9.4 |
��ȫ���� | 3.2 | 5.2 | 9.7 | 12.4 |
��������NaOH��MgCl2��AlCl3���ֹ�����ɵĻ������������ˮ����1.16g��ɫ����������������Һ������1.00mol/LHCl��Һ������HCl��Һ����������ɳ����Ĺ�ϵ��ͼ��ʾ��
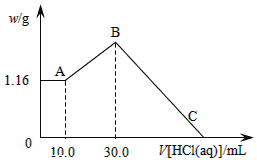
��1��ԭ�������NaOH��������____g��
��2��C�㣨��ʱ����ǡ����ȫ�ܽ⣩HCl��Һ�����Ϊ___mL��
��������������(ClO2������ɫ������ˮ������)�Ǹ�Ч���Ͷ������������ش��������⣺
ʵ������NH4Cl�����ᡢNaClO2(��������)Ϊԭ�ϣ�ͨ����ͼ1�����Ʊ�ClO2��
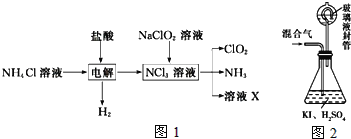
����ͼ2װ�ÿ��Բⶨ�������ClO2�ĺ�����
������ƿ�м��������ĵ⻯�أ���50mLˮ�ܽ���ټ���3mLϡ���
���ڲ���Һ��װ���м���ˮ��ʹҺ��û������Һ��ܵĹܿڣ�
��һ�����Ļ������ͨ����ƿ�����գ�
����������Һ��װ���е�ˮ������ƿ�У�
������0.1000molL1��������Ʊ���Һ�ζ���ƿ�е���Һ(I2+2S2O32-�T2I+S4O62-)��ָʾ����ʾ�յ�ʱ����ȥ20.00mL�����������Һ���ڴ˹����У�
�ٲ�û������ClO2������Ϊ___g��
����ClO2������������ˮ�Ậ��һ�������������Ρ���Ҫ��ȥ������������Σ��������������˵���___(����).
a.���� b.�⻯�� c.���� d.��������
����Ŀ������֪Ũ�ȵ�NaOH��Һ�ⶨijH2SO4��Һ��Ũ�ȣ��ο���ͼ�����±���ѡ����ȷѡ��(�� ��)

ѡ�� | ��ƿ����Һ | �ζ�������Һ | ѡ��ָʾ�� | ѡ�õζ��� |
A | �� | �� | ʯ�� | �� |
B | �� | �� | ��̪ | �� |
C | �� | �� | ���� | �� |
D | �� | �� | ��̪ | �� |
A. A B. B C. C D. D
����Ŀ������Դ�Ŀ����������������ɳ�����չ�ı�Ȼѡ����������������Դ�������õ���
|
|
|
|
A. �������� | B. ﮵�ع��� | C. ˮ������ | D. ̫���ܹ�ů |
A. A B. B C. C D. D