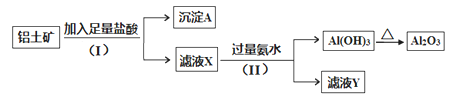
题目内容
【题目】为测定某碳酸氢钠样品的纯度,取21g含有杂质的碳酸氢钠样品投入到100mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体4.48L(标准状况)。
(1)该碳酸氢钠样品中碳酸氢钠的纯度________________。
(2)盐酸的物质的量浓度______________________。
要求:写出相关方程式及详细计算公式和步骤。
【答案】80﹪ 2mol/L
【解析】
根据NaHCO3 + HCl=NaCl+H2O+CO2↑结合标准状况下二氧化碳气体的体积列式计算。
(1)标准状况下,4.48L二氧化碳的物质的量为![]() =0.2mol。
=0.2mol。
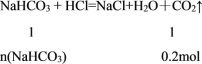 ,
,
![]() =
=![]() ,解得:n(NaHCO3)=0.2mol,则m(NaHCO3)=0.2mol×84g/mol=16.8g,该碳酸氢钠样品中碳酸氢钠的纯度为
,解得:n(NaHCO3)=0.2mol,则m(NaHCO3)=0.2mol×84g/mol=16.8g,该碳酸氢钠样品中碳酸氢钠的纯度为![]() ×100%=80﹪,故答案为:80﹪;
×100%=80﹪,故答案为:80﹪;
(2)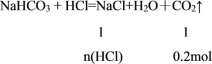
![]() =
=![]() ,解得:n(HCl)=0.2mol,则c(HCl)=
,解得:n(HCl)=0.2mol,则c(HCl)=![]() = 2mol/L,故答案为:2mol/L。
= 2mol/L,故答案为:2mol/L。

练习册系列答案
相关题目