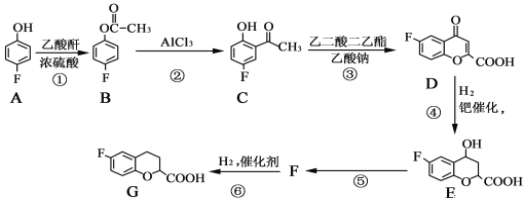
题目内容
【题目】碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
检验溶液中的阴、阳离子:取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是____和_____;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是_____。
测定碳铵中C元素和N元素质量比。该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示。

(3)碳铵固体应放在____中进行加热。
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(4)从安全的角度考虑,尾气处理的装置可以选用如图2_____;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是____g。
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理;_____(填“合理”“不合理”),理由是_____。
【答案】HCO3- CO32- NH4++OH-=NH3↑+H2O、HCO3-+OH-=CO32-+H2O(或NH4++HCO3-+2OH-=NH3↑+CO32-+2H2O) A A ![]() (a-b) 不合理 碳铵中可能含有HCO3-不能与BaCl2产生沉淀所测得碳元素质量分数不准确
(a-b) 不合理 碳铵中可能含有HCO3-不能与BaCl2产生沉淀所测得碳元素质量分数不准确
【解析】
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成,白色沉淀为碳酸钙;再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色,则气体为氨气,以此来解答。
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成,白色沉淀为碳酸钙,盐中阴离子可能为HCO3-、CO32-;再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色,则气体为氨气,则原固体中含铵根离子。
(1)由上述分析可知,阴离子可能为HCO3-、CO32-,故答案为:HCO3-;CO32-;
(2)碳铵与足量NaOH溶液加热反应的离子方程式可能是NH4++OH-=NH3↑+H2O、HCO3-+OH-=CO32-+H2O(或NH4++HCO3-+2OH-=NH3↑+CO32-+2H2O);
(3)ag碳铵,加热使之分解,碱石灰增重为水和二氧化碳的质量,尾气处理为氨气,因加热装置后连接U形管,则选择仪器只能为试管,故答案为:A;
(4)尾气处理,应防止倒吸,B不能防止倒吸,C中气体收集时导管应短进,D中为密闭容器,且导管没有插入液体中,只有A装置收集且能防倒吸,故答案为:A;
(5)灼烧后没有固体残余,称量U形管在实验前后的质量差为bg,则氨气的质量为(a-b)g,则含N质量为![]() (a-b)g,故答案为:
(a-b)g,故答案为:![]() (a-b);
(a-b);
(6)ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量,则
①不合理,因为碳铵中可能含有HCO3-不能与BaCl2产生沉淀所测得碳元素质量分数不准确;
②合理,因为碳铵中只含有CO32-加入BaCl2能完全生成沉淀可准确测得碳元素的质量;
故答案为:不合理;碳铵中可能含有HCO3-不能与BaCl2产生沉淀所测得碳元素质量分数不准确。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
已知:
颜色、状态 | 沸点(℃) | 密度(gcm﹣3) | |
苯甲酸* | 无色片状晶休 | 249 | 1.2659 |
苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
*苯甲酸在100℃会迅速升华.实验步骤如下:
①在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,控制温度在6570℃加热回流2h.反应时环己烷一乙醇﹣水会形成“共沸物”(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒人盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210213℃的馏分.
⑤检验合格,测得产品体积为13.16mL.
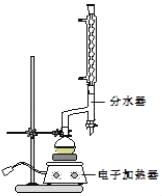
(1)在该实验中,圆底烧瓶的容积最适合的是_____(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中沸石的作用是____,使用分水器不断分离除去水的目的是_____.
(3)骤②中应控制馏分的温度在__.
A.215220℃ B.8590℃ C.7880℃ D.6570℃
(4)步骤③加入Na2CO3的作用是________;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是________.
(5)关于步骤④中的萃取分液操作叙述正确的是____.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为____.
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度