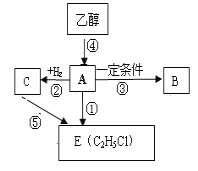
题目内容
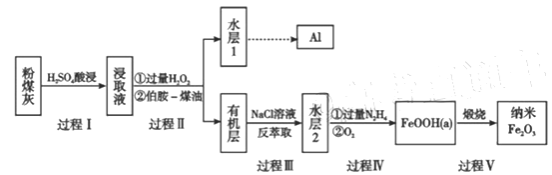
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
已知:
i)伯胺R-NH2能与Fe3+反应;3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:
(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是_________。
(2)写出过程II加入过量H2O2发生的离子方程式_________。加入伯胺-煤油对浸取液进行分离,该操作的名称是_________。
(3)从化学平衡角度解释过程III利用NaCl溶液进行反萃取的原理________。
(4)过程IV中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+.4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为_________。
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。
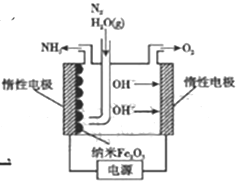
已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:该电解池第二步:2Fe+N2+3H2O=Fe2O3+2NH3。则该电解池第一步发生反应的方程式为_________。纳米Fe2O3在电解过程中所起的作用是_______。
【答案】SiO2 2Fe2++H2O2+2H+=2Fe3++2H2O 萃取、分液 Fe3++6Cl-![]() [FeCl6]3-(已知ⅱ中的反应),导致Fe3+浓度降低,使3R-NH2+Fe3++SO42-+H2O
[FeCl6]3-(已知ⅱ中的反应),导致Fe3+浓度降低,使3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+(已知ⅰ中的反应),平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转化到易溶于水的物质中,实现反萃取。 4:1 Fe2O3+3H2O+6e-=2Fe+6OH- 催化剂
Fe(NH2-R)3(OH)SO4+H+(已知ⅰ中的反应),平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转化到易溶于水的物质中,实现反萃取。 4:1 Fe2O3+3H2O+6e-=2Fe+6OH- 催化剂
【解析】
粉煤灰主要成分有Al2O3、Fe2O3、Fe2O4和SiO2等物质,过程Ⅰ酸浸,二氧化硅不溶于硫酸,除去二氧化硅;浸取液中含有Fe2+、Fe3+、Al3+,加入过氧化氢与Fe2+发生氧化还原反应生成Fe3+,再加入伯胺R-NH2与Fe3+反应;3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物,得到有机层。对有机层进行反萃取操作,Fe3+从易溶于煤油的物质中转化到易溶于水的物质中,再经过系列操作得到纳米三氧化二铁。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物,得到有机层。对有机层进行反萃取操作,Fe3+从易溶于煤油的物质中转化到易溶于水的物质中,再经过系列操作得到纳米三氧化二铁。
(1)过程I对煤粉灰进行酸浸,主要成分二氧化硅不溶于酸,故过滤后滤渣的主要成分是SiO2。
(2)过程II加入过量H2O2与Fe2+发生氧化还原反应生成Fe3+,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。加入伯胺-煤油对浸取液进行分离,得到有机层和水层1,该操作的名称是萃取、分液。
(3)Fe3++6Cl-![]() [FeCl6]3-(已知ⅱ中的反应),导致Fe3+浓度降低,使3R-NH2+Fe3++SO42-+H2O
[FeCl6]3-(已知ⅱ中的反应),导致Fe3+浓度降低,使3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+(已知ⅰ中的反应),平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转化到易溶于水的物质中,实现反萃取。
Fe(NH2-R)3(OH)SO4+H+(已知ⅰ中的反应),平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转化到易溶于水的物质中,实现反萃取。
(4)4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl-中,铁元素化合价降低,[FeCl6]3-作氧化剂,氮元素化合升高,N2H4作还原剂,但并不是所有参与反应的N2H4都作还原剂,5mol N2H4反应只有1mol作还原剂,故该反应中氧化剂与还原剂的物质的量之比为4:1。
(5)该装置为电解装置,阴极发生还原反应,总电极反应为N2+6e-+6H2O=2NH3+6OH-,已知阴极发生电极反应分两步进行,第二步:2Fe+N2+3H2O=Fe2O3+2NH3,则该电解池第一步发生反应的方程式为Fe2O3+3H2O+6e-=2Fe+6OH-。纳米Fe2O3在电解过程中质量和性质未发生改变,故其所起的作用是催化剂。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】下列有关实验操作和现象、结论都正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | 常温下,将大小、形状形态的锌和铝分别加入到等体积 | 锌比铝活泼 |
B | 向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀 | 该溶液中一定含有 |
C | 将盐酸滴入碳酸钠溶液中,产生气泡 | 非金属性:Cl大于C |
D | 向某溶液中加入氢氧化钠溶液丙加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有 |
A.AB.BC.CD.D