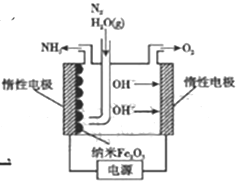
题目内容
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG![]() 变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
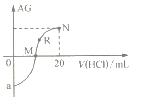
A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
【答案】B
【解析】
A. a点表示0.1mol·L-1一元弱碱XOH,若a=-8,则c(OH-)=10-3mol/L,所以Kb(XOH)≈![]() =
=![]() =10-5,故A正确;
=10-5,故A正确;
B. 两者恰好反应时,生成强酸弱碱盐,溶液显酸性。M点AG=0,则溶液中c(H+)= c(OH-),溶液呈中性,所以溶质为XOH和XCl,两者不是恰好完全反应,故B错误;
C. 若R点恰好为XCl溶液时,根据物料守恒可得c(X+)+c(XOH)=c(C1-),故C正确;
D. M点的溶质为XOH和XCl,继续加入盐酸,直至溶质全部为XCl时,该过程水的电离程度先增大,然后XCl溶液中再加入盐酸,水的电离程度减小,所以从M点到N点,水的电离程度先增大后减小,故D正确。
故选B。

练习册系列答案
相关题目