题目内容
【题目】氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1= -159.5kJ·mol-1
NH2CO2NH4(s) △H1= -159.5kJ·mol-1
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1
CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1
反应III:H2O(l)=H2O(g) △H3=+44.0kJmol-1
则反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l) △H=______kJmol-1
CO(NH2)2(s)+H2O(l) △H=______kJmol-1
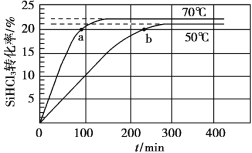
(2)将氨气与二氧化碳在有催化剂的反应器中反应2NH3(g)+CO2(g)![]() CO(NH2)2 (s)+H2O(g),体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
CO(NH2)2 (s)+H2O(g),体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
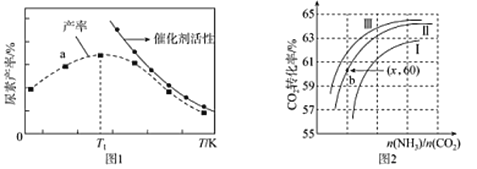
①a点_______(填是或不是)处于平衡状态,Tl之后尿素产率下降的原因是________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比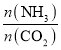 、水碳比
、水碳比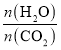 的变化关系。曲线I、II、III对应的水碳比最大的是_______,测得b点氨的转化率为30%,则x=___________。
的变化关系。曲线I、II、III对应的水碳比最大的是_______,测得b点氨的转化率为30%,则x=___________。
③已知该反应的v(正)=k(正)c2(NH3)c(CO2),v(逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正)、k(逆)的关系式是___________。
(3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:N2H4+H2O![]() N2H5++OH- K1=1×10-a;N2H5++H2O
N2H5++OH- K1=1×10-a;N2H5++H2O![]() N2H62++OH- K2=1×10一b。
N2H62++OH- K2=1×10一b。
①25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围__________(用含a、b式子表示)。
②水合肼(N2H4H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为_____。
【答案】-87.0 不是 升高温度反应逆向移动,催化剂活性降低 I 4 K=![]() 14-b<pH<14-a N2H5HSO4
14-b<pH<14-a N2H5HSO4
【解析】
(1)反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1= -159.5kJ·mol-1 ①
NH2CO2NH4(s) △H1= -159.5kJ·mol-1 ①
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1 ②
CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1 ②
反应III:H2O(l)=H2O(g) △H3=+44.0kJmol-1 ③
利用盖斯定律,将①+②-③,即得反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)的△H。
CO(NH2)2(s)+H2O(l)的△H。
(2)①在T1之后,升高温度,尿素的产率降低,说明平衡逆向移动,正反应为放热反应。也就是温度越高,达平衡时氨的转化率越低,若a点达平衡,则氨的产率比T1点大。
②对于反应体系,在氨碳比相同的情况下,增大水蒸气的量,平衡逆向移动,CO2的转化率降低。对于b点,氨的转化率为30%,CO2的转化率为60%,由变化量之比等于化学计量数之比,可求出x。
③已知该反应的v(正)=k(正)c2(NH3)c(CO2),v(逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡时,v(正)= v(逆),由此可求出平衡常数K与k(正)、k(逆)的关系式。
(3) K1=![]() =1×10-a,由c(N2H5+)>c(N2H4),可求出c(OH-)<1×10-a;K2=
=1×10-a,由c(N2H5+)>c(N2H4),可求出c(OH-)<1×10-a;K2=![]() =1×10一b,由c(N2H5+)>c(N2H62+),可求出c(OH-)>1×10一b,由此可求出应控制溶液pH范围。
=1×10一b,由c(N2H5+)>c(N2H62+),可求出c(OH-)>1×10一b,由此可求出应控制溶液pH范围。
②水合肼(N2H4H2O)的性质类似一水合氨,与硫酸反应可以生成硫酸氢盐,由此可得出该盐的化学式。
(1)反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1= -159.5kJ·mol-1 ①
NH2CO2NH4(s) △H1= -159.5kJ·mol-1 ①
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1 ②
CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1 ②
反应III:H2O(l)=H2O(g) △H3=+44.0kJmol-1 ③
利用盖斯定律,将①+②-③,即得反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)的△H= -87.0 kJmol-1。答案为:-87.0;
CO(NH2)2(s)+H2O(l)的△H= -87.0 kJmol-1。答案为:-87.0;
(2)①在T1之后,升高温度,尿素的产率降低,说明平衡逆向移动,正反应为放热反应。也就是温度越高,达平衡时氨的转化率越低,若a点达平衡,则氨的产率比T1点大。所以a点不是处于平衡状态,Tl之后尿素产率下降的原因是升高温度反应逆向移动,催化剂活性降低。答案为:不是;升高温度反应逆向移动,催化剂活性降低;
②对于反应体系,在氨碳比相同的情况下,增大水蒸气的量,平衡逆向移动,CO2的转化率降低,从而得出曲线I、II、III对应的水碳比最大的是I。对于b点,氨的转化率为30%,CO2的转化率为60%,由变化量之比等于化学计量数之比可得,![]() ,可求出x=
,可求出x=![]() =4。答案为:I;4;
=4。答案为:I;4;
③已知该反应的v(正)=k(正)c2(NH3)c(CO2),v(逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡时,v(正)= v(逆),k(正)c2(NH3)c(CO2)=k(逆)c(H2O),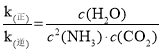 =K。答案为:K=
=K。答案为:K=![]() ;
;
(3) K1=![]() =1×10-a,由c(N2H5+)>c(N2H4),可求出c(OH-)<1×10-a,则pH<14-a;K2=
=1×10-a,由c(N2H5+)>c(N2H4),可求出c(OH-)<1×10-a,则pH<14-a;K2=![]() =1×10一b,由c(N2H5+)>c(N2H62+),可求出c(OH-)>1×10一b,pH>14-b,由此可求出应控制溶液pH范围为14-b<pH<14-a。答案为:14-b<pH<14-a;
=1×10一b,由c(N2H5+)>c(N2H62+),可求出c(OH-)>1×10一b,pH>14-b,由此可求出应控制溶液pH范围为14-b<pH<14-a。答案为:14-b<pH<14-a;
②水合肼(N2H4H2O)的性质类似一水合氨,与硫酸反应可以生成硫酸氢盐,由此可得出该盐的化学式为N2H5HSO4。答案为:N2H5HSO4。

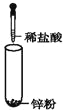
【题目】下列表格中的各种情况,可以用右图的曲线表示的是 ( )
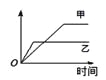
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
D | 2 molSO2和1 molO2,在相同温度下2SO2+ O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. AB. BC. CD. D