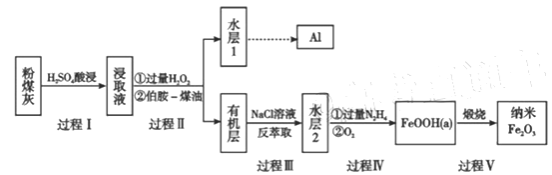
题目内容
【题目】下列金属冶炼的反应原理,不正确的是
A.2Ag2O![]() 4Ag+O2↑B.Fe2O3+3CO
4Ag+O2↑B.Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
C.6MgO+4Al![]() 6Mg+2Al2O3D.2NaCl(熔融)
6Mg+2Al2O3D.2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
【答案】C
【解析】
金属冶炼的方法与金属活泼性有关,金属冶炼的方法有:电解法:冶炼活泼金属Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,以此来解答。
A.Ag为不活泼金属,可利用热分解法冶炼,故A正确;
B.Fe为较不活泼金属,可利用还原法冶炼,故B正确;
C.MgO的熔点高,且Mg为活泼金属,应电解熔融氯化镁冶炼Mg,故C错误;
D. Na为活泼金属,电解熔融氯化钠可冶炼Na,故D正确;
故答案为C。

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)①④⑥三种元素构成的化合物的电子式:__;⑨的最高价氧化物对应水化物的化学式:__。
(2)⑤、⑦、⑧的简单离子半径由大到小的顺序:__(用离子符号填写)。
(3)用一个化学方程式表示④、⑤二种元素非金属性的强弱__。
(4)⑦的单质与⑥的最高价氧化物对应水化物的水溶液反应的离子方程式为__。
(5)元素①、元素④以原子个数比为1∶1形成化合物Q,元素①、元素③形成化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终产物对空气没有污染,写出该反应的化学方程式:__。