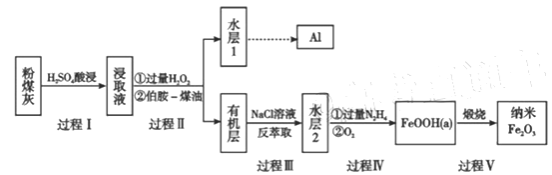
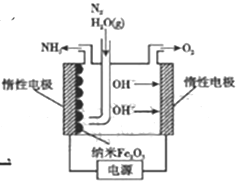
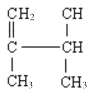
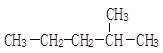题目内容
【题目】[Cu(NH3)4]SO4是一种深蓝色的配位化合物。
(1)Cu2+可被还原成Cu+,Cu+基态核外的外围电子排布式为_________________________。
(2)H元素与N元素可形成分子式为N2H2的化合物,该物质的分子具有平面结构,则该分子中N原子的杂化轨道类型为______________________。
(3)与CS2分子互为等电子体的SCN-离子的电子式为_________________。
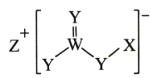
(4)Cu可形成多种配合物,且各种配合物有广乏的用途。某Cu的配合物结构如图1所示,则该配合物中心原子Cu的配体数为____;其分子内含有的作用力有________(填序号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位健
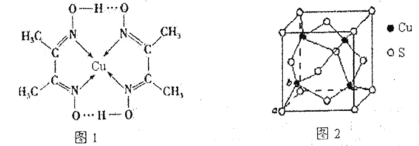
(5)Cu元素与S元素形成的一种化合物品跑如图2所示,其中S的配位数为______________。
【答案】3d10 sp2 ![]() 2 ACE 4
2 ACE 4
【解析】
(1)Cu+基态核外3d能级上10个电子为其价电子;
(2)H元素与N元素可形成分子式为N2H2的化合物,该物质的分子具有平面结构,其结构式为H-N=N-H,该分子中N价层电子对个数是3且含有一个孤电子对,根据价层电子对互斥理论判断N原子杂化类型;
(3)等电子体结构相似,与CS2分子互为等电子体的SCN-离子结构中S和N都分别与C原子形成双键;
(4)某Cu的配合物结构如下图1所示,则该配合物中心原子Cu的配体数为2,其分子内碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键;
(5)根据图知,每个S原子连接4个Cu原子。
(1)Cu为29号元素,其核外电子排布为1s22s22p63s23p63d104s1,失去一个电子得到Cu+;Cu+基态核外3d能级上10个电子为其价电子,其价电子排布式为3d10;
(2)H元素与N元素可形成分子式为N2H2的化合物,该物质的分子具有平面结构,其结构式为H-N=N-H,该分子中N价层电子对个数![]() ,含有一个孤电子对,N原子杂化类型为sp2;
,含有一个孤电子对,N原子杂化类型为sp2;
(3)等电子体结构相似,CS2中S和C之间形成双键,则与CS2分子互为等电子体的SCN-离子结构中S和N都分别与C原子形成双键,其结构式为![]() ;
;
(4)从图1可知,则该配合物中心原子Cu的配体数为2,其分子内碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键,所以存在氢键、配位键和共价键,答案为ACE;
(5)根据图知,以上底面面心上S原子为例,该S原子连接该晶胞中2个Cu原子,还连接该晶胞上面晶胞中2个Cu原子,所以每个S原子连接4个Cu原子,即其配位数是4。

【题目】X、Y两根金属棒插入Z溶液中构成如图所示装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )

编号 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Ag | Zn | 硝酸银溶液 |
C | Cu | Ag | 硫酸铜溶液 |
D | Cu | Zn | 稀硫酸 |
A.AB.BC.CD.D
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)①④⑥三种元素构成的化合物的电子式:__;⑨的最高价氧化物对应水化物的化学式:__。
(2)⑤、⑦、⑧的简单离子半径由大到小的顺序:__(用离子符号填写)。
(3)用一个化学方程式表示④、⑤二种元素非金属性的强弱__。
(4)⑦的单质与⑥的最高价氧化物对应水化物的水溶液反应的离子方程式为__。
(5)元素①、元素④以原子个数比为1∶1形成化合物Q,元素①、元素③形成化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终产物对空气没有污染,写出该反应的化学方程式:__。