题目内容
已知反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,请回答下列问题:
(1)请用双线桥法标出电子转移的方向和数目______
(2)上述反应中,______元素被氧化,______是氧化剂,请将上述反应改写成离子方程式:______
(3)反应中生成15gNO时,消耗还原剂的质量______ g,参加反应的HNO3为______g,反应中被还原的HNO3与未被还原的HNO3的质量比为______.
(1)请用双线桥法标出电子转移的方向和数目______
(2)上述反应中,______元素被氧化,______是氧化剂,请将上述反应改写成离子方程式:______
(3)反应中生成15gNO时,消耗还原剂的质量______ g,参加反应的HNO3为______g,反应中被还原的HNO3与未被还原的HNO3的质量比为______.
(1)该氧化还原反应中的,化合价升高的是铜元素,化合价降低的是硝酸中的氮元素,转移电子数为6mol,双线桥法表示电子转移的方向和数目如下所示:

,故答案为:

;
(2)化合价升高的是铜元素,被氧化,化合价降低的元素是氮元素,所在的反应物硝酸是氧化剂,改成离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:Cu;HNO3;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)根据反应中硝酸、铜以及一氧化氮的量的关系为:3Cu~8HNO3~2NO,即反应中生成1molNO时,消耗还原剂Cu的物质的量是1.5mol,消耗硝酸4mol,当生成15gNO时,
消耗铜的质量=
×1.5mol×64g/mol=48g,参加反应的HNO3为
×4mol×63g/mol=126g,反应中被还原的HNO3与未被还原的HNO3的质量比等于物质的量之比,
即为2:(8-2)=1:3,故答案为:48;252;3:1.

,故答案为:

;
(2)化合价升高的是铜元素,被氧化,化合价降低的元素是氮元素,所在的反应物硝酸是氧化剂,改成离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:Cu;HNO3;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)根据反应中硝酸、铜以及一氧化氮的量的关系为:3Cu~8HNO3~2NO,即反应中生成1molNO时,消耗还原剂Cu的物质的量是1.5mol,消耗硝酸4mol,当生成15gNO时,
消耗铜的质量=
| 15g |
| 30g/mol |
| 15g |
| 30g/mol |
即为2:(8-2)=1:3,故答案为:48;252;3:1.

练习册系列答案
相关题目
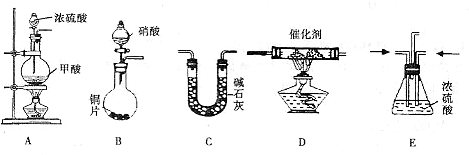
 ( )→( )→( )→收集气体
( )→( )→( )→收集气体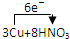 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O
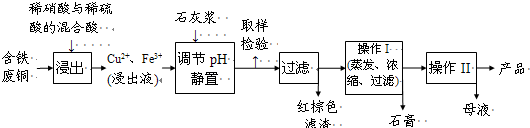
 硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示).
硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示).