题目内容
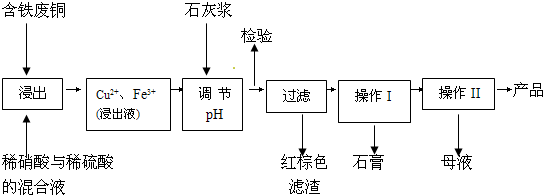
I.硫酸铜是一种应用极其广泛的化工原料.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4?5H2O)的生产流程示意图: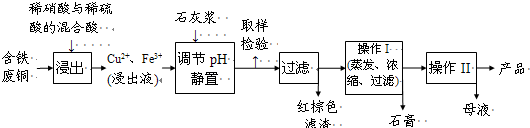
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
请回答下列问题:
(1)红棕色滤渣的主要成分是
(2)写出浸出过程中生成硫酸铜的化学方程式
(3)操作I的操作温度应该控制在
(4)从溶液中分离出硫酸铜晶体的操作II应为
(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;
方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是
②指出你认为不合理的方案存在的问题
(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案
II.(12分)复印机使用的墨粉主要成份是Fe3O4,图是氧化沉淀法生产Fe3O4的工艺: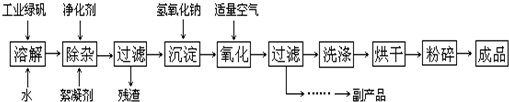
已知:
①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
②Fe(OH)2+2Fe(OH)3═Fe3O4?4H2O
请回答下列问题:
(1)铁的常见氧化物有
(2)Fe3O4与盐酸反应的化学方程式是:
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:
(4)生产中可获得的副产品是
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16kg/h,为使产品较纯,鼓入空气的速率应为

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
(1)红棕色滤渣的主要成分是
Fe(OH)3
Fe(OH)3
;(2)写出浸出过程中生成硫酸铜的化学方程式
3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O
3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O
;(3)操作I的操作温度应该控制在
100
100
℃左右;(4)从溶液中分离出硫酸铜晶体的操作II应为
冷却结晶、过滤
冷却结晶、过滤
、洗涤、干燥;(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;
方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是
方案二
方案二
;②指出你认为不合理的方案存在的问题
Cu2+的蓝色对检验有干扰
Cu2+的蓝色对检验有干扰
;(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案
4NO+3O2+H2O=4HNO3
4NO+3O2+H2O=4HNO3
.II.(12分)复印机使用的墨粉主要成份是Fe3O4,图是氧化沉淀法生产Fe3O4的工艺:

已知:
①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
②Fe(OH)2+2Fe(OH)3═Fe3O4?4H2O
请回答下列问题:
(1)铁的常见氧化物有
FeO、Fe2O3、Fe3O4
FeO、Fe2O3、Fe3O4
;(2)Fe3O4与盐酸反应的化学方程式是:
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
,检验反应后的溶液中含Fe3+的方法:取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+
取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+
;(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:
4Fe(OH)2+2H2O+O2=4Fe(OH)3
4Fe(OH)2+2H2O+O2=4Fe(OH)3
;(4)生产中可获得的副产品是
Na2SO4?10H2O
Na2SO4?10H2O
,提取该副产品的操作顺序是:bcdae
bcdae
(填写序号)a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16kg/h,为使产品较纯,鼓入空气的速率应为
0.784
0.784
m3/h(假设反应在标准状态下进行,空气中O2占20%).分析:Ⅰ.(1)由工艺流程图转化关系可知,红褐色滤渣的主要成分为氢氧化铁;
(2)由工艺流程图转化关系可知,由于硫酸的存在,酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水;
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,物质分离较完全,制备的胆矾较纯;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥;
(5)确认Fe3+是否除净应注意铜离子的颜色造成的干扰;
(6)一氧化氮循环使用可以利用一氧化氮和氧气再水溶液中反应生成硝酸,重新使用;
Ⅱ.(1)铁有三种常见的氧化物:FeO、Fe2O3、Fe3O4;
(2)根据铁元素的化合价+2、+3价写出生成物的两种金属氯化物的化学式,然后再根据式子两边各元素的原子个数相等配平方程式,Fe3+与硫氰化钾溶液反应,使溶液变红色,据此解答;
(3)氢氧化亚铁易被氧气氧化;
(4)根据从硫酸钠溶液中分离出硫酸钠的方法分析操作过程;
(5)根据反应的化学方程式进行分析.
(2)由工艺流程图转化关系可知,由于硫酸的存在,酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水;
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,物质分离较完全,制备的胆矾较纯;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥;
(5)确认Fe3+是否除净应注意铜离子的颜色造成的干扰;
(6)一氧化氮循环使用可以利用一氧化氮和氧气再水溶液中反应生成硝酸,重新使用;
Ⅱ.(1)铁有三种常见的氧化物:FeO、Fe2O3、Fe3O4;
(2)根据铁元素的化合价+2、+3价写出生成物的两种金属氯化物的化学式,然后再根据式子两边各元素的原子个数相等配平方程式,Fe3+与硫氰化钾溶液反应,使溶液变红色,据此解答;
(3)氢氧化亚铁易被氧气氧化;
(4)根据从硫酸钠溶液中分离出硫酸钠的方法分析操作过程;
(5)根据反应的化学方程式进行分析.
解答:解:Ⅰ.(1)由工艺流程图转化关系可知,浸出液中加入石灰浆调节pH值,铁离子转化为Fe(OH)3沉淀析出,红褐色滤渣的主要成分为Fe(OH)3,
故答案为:Fe(OH)3;
(2)由于硫酸的存在,且酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水,
反应方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O,
故答案为:3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,温度应该控制在100℃,制备的胆矾相对较纯,
故答案为:100℃;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥,
故答案为:冷却结晶、过滤;
(5)①方案一:取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在;方案二:径向层析→喷KSCN溶液,纸上层析是利用混合物中各组分在固定相和流动相中的溶解度不同而达到分离目的,不但可以分辨出铁离子还能辨别出含有铜离子,
故答案为:方案二;
②取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在,
故答案为:Cu2+的蓝色对检验有干扰;
(6)一氧化氮气体有毒污染空气不能排放到大气中,可以利用一氧化氮和氧气在水溶液中吸收生成硝酸循环使用反应的化学方程式4NO+3O2+H2O=4HNO3,
故答案为:4NO+3O2+H2O=4HNO3;
Ⅱ.(1)铁有三种常见的氧化物:FeO、Fe2O3、Fe3O4,
故答案为:FeO、Fe2O3、Fe3O4;
(2)四氧化三铁与盐酸反应生成氯化亚铁、氯化铁与水,配平后方程式为Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,
Fe3+与硫氰化钾溶液反应,使溶液变红色,所以检验是否含Fe3+离子的方法为:取少量待测液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+,
故答案为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+;
(3)Fe(OH)2不稳定,易被氧气氧化为Fe(OH)3,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(4)氢氧化钠和硫酸亚铁溶液反应后生成氢氧化亚铁和硫酸钠,所以副产品是硫酸钠,由硫酸钠溶液变为失去结晶水的硫酸钠的过程为:加热浓缩,冷却,结晶,过滤,洗涤,即bcdae,
故答案为:Na2SO4?10H2O(或芒硝,写Na2SO4也可);bcdae;
(5)鼓入的空气应恰好与FeSO4完全反应,
12.16 kg工业绿矾中含FeSO4的物质的量:
=42mol,设鼓入空气的速率应为Vm3/h,
根据:6 FeSO4~O2~2 Fe3O4
6mol 22.4L
42mol Vm3×103L/m3×1/5
解得:V=0.784,
故答案为:0.784.
故答案为:Fe(OH)3;
(2)由于硫酸的存在,且酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水,
反应方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O,
故答案为:3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,温度应该控制在100℃,制备的胆矾相对较纯,
故答案为:100℃;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥,
故答案为:冷却结晶、过滤;
(5)①方案一:取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在;方案二:径向层析→喷KSCN溶液,纸上层析是利用混合物中各组分在固定相和流动相中的溶解度不同而达到分离目的,不但可以分辨出铁离子还能辨别出含有铜离子,
故答案为:方案二;
②取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在,
故答案为:Cu2+的蓝色对检验有干扰;
(6)一氧化氮气体有毒污染空气不能排放到大气中,可以利用一氧化氮和氧气在水溶液中吸收生成硝酸循环使用反应的化学方程式4NO+3O2+H2O=4HNO3,
故答案为:4NO+3O2+H2O=4HNO3;
Ⅱ.(1)铁有三种常见的氧化物:FeO、Fe2O3、Fe3O4,
故答案为:FeO、Fe2O3、Fe3O4;
(2)四氧化三铁与盐酸反应生成氯化亚铁、氯化铁与水,配平后方程式为Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,
Fe3+与硫氰化钾溶液反应,使溶液变红色,所以检验是否含Fe3+离子的方法为:取少量待测液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+,
故答案为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+;
(3)Fe(OH)2不稳定,易被氧气氧化为Fe(OH)3,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(4)氢氧化钠和硫酸亚铁溶液反应后生成氢氧化亚铁和硫酸钠,所以副产品是硫酸钠,由硫酸钠溶液变为失去结晶水的硫酸钠的过程为:加热浓缩,冷却,结晶,过滤,洗涤,即bcdae,
故答案为:Na2SO4?10H2O(或芒硝,写Na2SO4也可);bcdae;
(5)鼓入的空气应恰好与FeSO4完全反应,
12.16 kg工业绿矾中含FeSO4的物质的量:
| 12160g×52.5% |
| 152g/mol |
根据:6 FeSO4~O2~2 Fe3O4
6mol 22.4L
42mol Vm3×103L/m3×1/5
解得:V=0.784,
故答案为:0.784.
点评:本题为拼合型题目,题量大,对学生的心理素质有非常高的要求,考查学生对工艺流程的理解、阅读题目获取信息能力、物质分离提纯等基本操作、离子检验,化学计算等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.

练习册系列答案
相关题目