题目内容
I.下列实验操作、试剂保存方法和实验室事故处理,一定正确的是
A.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂并中;
B.制备氢氧化铁胶体时,应向20mL沸水中逐滴滴加1~2mL饱和的FeCl3溶液,并继续加热到液体呈透明的红褐色为止;
C.在石油的分馏实验中,温度计需插入液体中;
D.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液;
E.用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
F.在进行中和热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、取用的碱溶液略过量、进行两到三次实验取平均值.
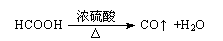
II.汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等.治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2.某小组在实验室利用下图所示装置模拟处理汽车尾气中CO和NOX的反应并测量反应后混合气体的组成.(已知HCOOH
CO↑+H2O)
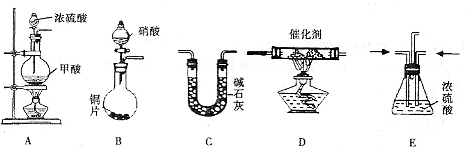
试回答下列问题:
(1)仪器的连接顺序为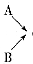 ( )→( )→( )→收集气体
( )→( )→( )→收集气体
(2)E装置的作用是
(3)写出D中的NOX与CO反应的化学方程式
(4)若B容器中生成的NOX为NO,写出该反应的化学方程式,并标出电子转移的方向和数目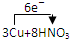 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O =3Cu(NO3)2+2NO↑+4H2O.
=3Cu(NO3)2+2NO↑+4H2O.
(5)若通入的NOX为NO,C装置增重8.8g,收集到的气体在标准状况下为4.48L(其相对分子质量为28.4).则收集到的气体中NO的物质的量为
(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法是否正确并阐述理由:
BDE
BDE
(填序号).A.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂并中;
B.制备氢氧化铁胶体时,应向20mL沸水中逐滴滴加1~2mL饱和的FeCl3溶液,并继续加热到液体呈透明的红褐色为止;
C.在石油的分馏实验中,温度计需插入液体中;
D.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液;
E.用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
F.在进行中和热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、取用的碱溶液略过量、进行两到三次实验取平均值.
II.汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等.治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2.某小组在实验室利用下图所示装置模拟处理汽车尾气中CO和NOX的反应并测量反应后混合气体的组成.(已知HCOOH
| ||
| △ |

试回答下列问题:
(1)仪器的连接顺序为
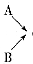 ( )→( )→( )→收集气体
( )→( )→( )→收集气体(2)E装置的作用是
干燥混合气体
干燥混合气体
、通过观察气泡,调节气体流速,使气体充分混合
通过观察气泡,调节气体流速,使气体充分混合
.(3)写出D中的NOX与CO反应的化学方程式
2NOx+2xC
N2+2xCO2;
| 催化剂 |
| 加热 |
2NOx+2xC
N2+2xCO2;
.| 催化剂 |
| 加热 |
(4)若B容器中生成的NOX为NO,写出该反应的化学方程式,并标出电子转移的方向和数目
 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O(5)若通入的NOX为NO,C装置增重8.8g,收集到的气体在标准状况下为4.48L(其相对分子质量为28.4).则收集到的气体中NO的物质的量为
0.04mol
0.04mol
.(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法是否正确并阐述理由:
不正确,因为①该反应为可逆反应,不能反应完全,②没达到“零碳排放”的目的,对气候的变化存在潜在的影响和危害
不正确,因为①该反应为可逆反应,不能反应完全,②没达到“零碳排放”的目的,对气候的变化存在潜在的影响和危害
.分析:Ⅰ、根据物质的性质来选择保存方法和事故处理方法,浓硝酸具有强氧化性,见光易分解;浓碱具有腐蚀性,滴到皮肤上,用大量水冲洗,并涂上硼酸溶液;高锰酸钾酸性溶液具有强氧化性,应用酸指滴定管;根据实验原理和实验目的判断操作的正确性,高锰酸钾酸性溶液具有强氧化性,应用酸式滴定管量取;石油分馏测量的是馏分的温度;中和热测定,应防止热量散失、碱液略过量,多次测量求平均值;
Ⅱ、(1)根据实验目的和实验原理,选择仪器的连接顺序;
(2)浓硫酸用来干燥气体,调整气体流速;
(3)根据题干所给信息书写化学方程式;
(4)装置B中铜和硝酸反应生成硝酸铜、一氧化氮和水,写出化学方程式并标出电子转移方向和数目;
(5)根据的化学方程式和所给数据求出收集到的气体中氮气的物质的量,再求出NO的物质的量;
(6)处理汽车尾气的反应为可逆反应,反应不完全,没达到零排放的要求.
Ⅱ、(1)根据实验目的和实验原理,选择仪器的连接顺序;
(2)浓硫酸用来干燥气体,调整气体流速;
(3)根据题干所给信息书写化学方程式;
(4)装置B中铜和硝酸反应生成硝酸铜、一氧化氮和水,写出化学方程式并标出电子转移方向和数目;
(5)根据的化学方程式和所给数据求出收集到的气体中氮气的物质的量,再求出NO的物质的量;
(6)处理汽车尾气的反应为可逆反应,反应不完全,没达到零排放的要求.
解答:解:Ⅰ、A、浓硝酸具有强氧化性,能腐蚀橡胶,不能用橡胶塞,且浓硝酸见光易分解,所以浓硝酸应保存在带玻璃塞的棕色细口试剂瓶中,故A错误;
B、制备氢氧化铁胶体时,应向20mL沸水中逐滴滴加1~2mL饱和的氯化铁溶液,继续煮沸至溶液呈红褐色,停止加热,就得到氯化铁胶体,故B正确;
C、石油分馏实验中,测得是馏分,也就是气体的温度,温度计不能插入液面下,故C错误;
D、浓碱具有强腐蚀性,不小心洒在皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液,故D正确;
E、高锰酸钾酸性溶液具有强氧化性,能腐蚀橡胶,不能用碱式滴定管,应用酸式滴定管量取,故E正确;
F、进行中和热测定时,为保证实验准确性,应防止热量散失,碱液略过量,多次测量求平均值,不能用铜质搅拌棒搅拌,应用玻璃搅拌棒,故F错误;
故选:BDE;
Ⅱ、(1)该反应目的是模拟汽车尾气中CO和NOX的反应并测量反应后混合气体的组成,装置A生成的CO和装置B生成的NOx通入装置E干燥气体并调整气体流速,再通入装置D反应,反应后的气体通入装置C吸收生成的二氧化碳,最后收集气体.
(2)装置E中盛放浓硫酸,浓硫酸具有吸水性,所以装置C的作用是:干燥混合气体,通过观察气泡,调节气体流速,使气体充分混合;
(3)由题干可知:利用催化剂使CO和NOX发生反应大部分转化为CO2和N2,所以该反应为可逆反应,反应条件是催化剂、加热,再根据得失电子守恒和质量守恒配平,
得到方程式2NOx+2xC
N2+2xCO2;
(3)若装置B生成的NOX为NO,铜和硝酸反应生成硝酸铜、一氧化氮和水,铜为还原剂,失电子,硝酸中的氮得电子,硝酸为氧化剂,化学方程式为: ═3Cu(NO3)2+2NO↑+4H2O;
═3Cu(NO3)2+2NO↑+4H2O;
(4)通入的NOX为NO时,发生的反应为:2CO+2NO
2CO2+N2,
88g 22.4L
C装置增重8.8g,即生成二氧化碳8.8g,
生成的氮气的体积=
=2.24L,氮气的物质的量=
=0.1mol;
则收集的气体中有氮气0.1mol,一氧化碳和一氧化氮混合气体的物质的量=
-0.01mol=0.1mol;
假设收集的气体中有xmol一氧化氮,则有(0.1-x)mol一氧化碳,
可得:0.1mol×28g?mol-1+xmol×30g?mol-1+(0.1-x)mol×28g?mol-1=0.2mol×28.4g?mol-1;
解之得:x=0.04
所以收集到的气体中,一氧化氮的物质的量为0.04mol;
(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法不正确,因为①该反应为可逆反应,不能反应完全,②没达到“零碳排放”的目的,对气候的变化存在潜在的影响和危害.
故答案为:Ⅰ、BDE;
Ⅱ、(1)E、D、C;
(2)干燥混合气体;通过观察气泡,调节气体流速,使气体充分混合;
(3)2NOx+2xC
N2+2xCO2;
(4) =3Cu(NO3)2+2NO↑+4H2O;
=3Cu(NO3)2+2NO↑+4H2O;
(5)0.04mol;
(6)不正确,因为①该反应为可逆反应,不能反应完全.②没达到“零碳排放”的目的,对气候的变化存在潜在的影响和危害.
B、制备氢氧化铁胶体时,应向20mL沸水中逐滴滴加1~2mL饱和的氯化铁溶液,继续煮沸至溶液呈红褐色,停止加热,就得到氯化铁胶体,故B正确;
C、石油分馏实验中,测得是馏分,也就是气体的温度,温度计不能插入液面下,故C错误;
D、浓碱具有强腐蚀性,不小心洒在皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液,故D正确;
E、高锰酸钾酸性溶液具有强氧化性,能腐蚀橡胶,不能用碱式滴定管,应用酸式滴定管量取,故E正确;
F、进行中和热测定时,为保证实验准确性,应防止热量散失,碱液略过量,多次测量求平均值,不能用铜质搅拌棒搅拌,应用玻璃搅拌棒,故F错误;
故选:BDE;
Ⅱ、(1)该反应目的是模拟汽车尾气中CO和NOX的反应并测量反应后混合气体的组成,装置A生成的CO和装置B生成的NOx通入装置E干燥气体并调整气体流速,再通入装置D反应,反应后的气体通入装置C吸收生成的二氧化碳,最后收集气体.
(2)装置E中盛放浓硫酸,浓硫酸具有吸水性,所以装置C的作用是:干燥混合气体,通过观察气泡,调节气体流速,使气体充分混合;
(3)由题干可知:利用催化剂使CO和NOX发生反应大部分转化为CO2和N2,所以该反应为可逆反应,反应条件是催化剂、加热,再根据得失电子守恒和质量守恒配平,
得到方程式2NOx+2xC
| 催化剂 |
| 加热 |
(3)若装置B生成的NOX为NO,铜和硝酸反应生成硝酸铜、一氧化氮和水,铜为还原剂,失电子,硝酸中的氮得电子,硝酸为氧化剂,化学方程式为:
 ═3Cu(NO3)2+2NO↑+4H2O;
═3Cu(NO3)2+2NO↑+4H2O;(4)通入的NOX为NO时,发生的反应为:2CO+2NO
| 催化剂 |
| 加热 |
88g 22.4L
C装置增重8.8g,即生成二氧化碳8.8g,
生成的氮气的体积=
| 22.4L×8.8g |
| 88g |
| 2.24L |
| 22.4L?mol-1 |
则收集的气体中有氮气0.1mol,一氧化碳和一氧化氮混合气体的物质的量=
| 4.48L |
| 22.4L?mol-1 |
假设收集的气体中有xmol一氧化氮,则有(0.1-x)mol一氧化碳,
可得:0.1mol×28g?mol-1+xmol×30g?mol-1+(0.1-x)mol×28g?mol-1=0.2mol×28.4g?mol-1;
解之得:x=0.04
所以收集到的气体中,一氧化氮的物质的量为0.04mol;
(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法不正确,因为①该反应为可逆反应,不能反应完全,②没达到“零碳排放”的目的,对气候的变化存在潜在的影响和危害.
故答案为:Ⅰ、BDE;
Ⅱ、(1)E、D、C;
(2)干燥混合气体;通过观察气泡,调节气体流速,使气体充分混合;
(3)2NOx+2xC
| 催化剂 |
| 加热 |
(4)
 =3Cu(NO3)2+2NO↑+4H2O;
=3Cu(NO3)2+2NO↑+4H2O;(5)0.04mol;
(6)不正确,因为①该反应为可逆反应,不能反应完全.②没达到“零碳排放”的目的,对气候的变化存在潜在的影响和危害.
点评:本题考查化学试剂的存放和一些基本的实验操作,以及处理汽车尾气的模拟实验,综合性强,要注意平时知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 )
)

 CO↑+H2O)
CO↑+H2O)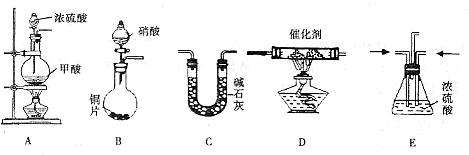
 →→→收集气体
→→→收集气体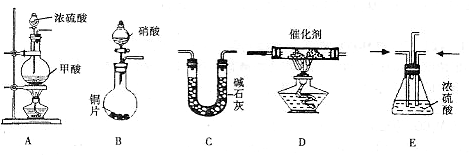
 CO↑+H2O)
CO↑+H2O)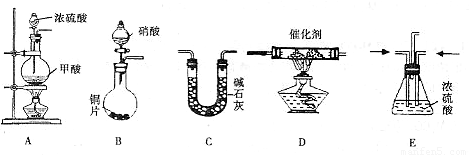
 ( )→( )→( )→收集气体
( )→( )→( )→收集气体