题目内容
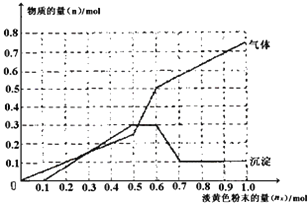
【题目】某无色透明溶液,可能含有下列离子:Mg2+、A13+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-。取该溶液进行如下实验:①取溶液少许,滴入AgNO3溶液产生白色沉淀;②取溶液少许,滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解;③取一定量的原溶液,加入一种淡黄色粉末状的固体X,产生气体的物质的量(n气体)、沉淀的物质的量(n沉淀)与加入淡黄色粉末的量(nx)的关系如下图所示(假设生成的气体全部逸出)。
根据实验现象和数据分析正确的是
A. 溶液中肯定大量存在的阳离子只有Mg2+、A13+、NH4+
B. 溶液中肯定没有的离子只有Fe3+、Ba2+
C. 当加入0.6mol淡黄色粉末时,生成两种气体分别为NH3和O2,其对应的体积比为2:3
D. 溶液中可能存在Cl-、HCO3-
【答案】C
【解析】无色溶液中一定不存在有色的Fe3+,根据①滴入AgNO3溶液产生白色沉淀可知,原溶液中可能含有的离子为:SO42-、HCO3-、Cl-;根据②滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解,该白色沉淀为硫酸钡,说明原溶液中一定存在SO42-,根据离子共存,一定不存在Ba2+;③根据图象变化,加入淡黄色粉末,立刻生成气体,开始时没有沉淀,之后沉淀逐渐增加,当加入0.5~0.6mol过氧化钠时没有沉淀生成,说明此时参加反应的离子为NH4+,之后沉淀部分溶解,溶解的沉淀为氢氧化铝,证明原溶液中一定存在Mg2+、Al3+;根据离子共存可知,一定不存在HCO3-;淡黄色粉末X为过氧化钠,原溶液中一定存在H+离子,根据以上分析可知,原溶液中一定存在的离子为:Mg2+、Al3+、H+、NH4+、SO42-,原溶液中一定不存在的离子为:Fe3+、Ba2+、HCO3-,可能存在氯离子。X为过氧化钠,当加入0.6mol淡黄色粉末时,生成氨气消耗过氧化钠的物质的量为0.6mol-0.5mol=0.1mol,说明铵根离子消耗了0.2mol氢氧化钠,溶液中含有铵根离子的物质的量为0.2mol,生成氨气的物质的量为0.2mol;根据反应2Na2O2+2CO2=2Na2CO3+O2,0.6mol过氧化钠完全反应生成了0.3mol氧气,所以生成的氨气与氧气的体积之比就等于物质的量之比:0.2mol:0.3mol=2:3,答案选C。