题目内容
【题目】“霾”是当今世界环境热点话题。目前我国许多地方空气质量恶化原因之—是机动车尾气和燃煤产生的烟气。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-akJ·mol-1 (a>0)
2CO2(g)+N2(g) △H=-akJ·mol-1 (a>0)
(1)在一定温度下,将2.0 mol NO、2.4 mol CO气体通入到固定容积为2L的密闭容器中,
反应过程中部分物质的浓度变化如图所示:
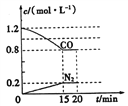
① 015 min N2的平均速率v(N2)=_______;NO的转化率为 _______。
②20 min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是_______(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的溫度不变,20 min时再向容器中充入NO、N2各0.4mol,化学平衡将________移动(选填“向左”、“向右”或“不”),重新达到平衡后,该反应的化学平衡常数为___________。
(2)已知:2NO(g)+O2(g)=2NO2(g) △H=-bkJ·mol-l (b>0)CO的燃烧热△H=-ckJ·mol-l(c>0)
则在消除汽车尾气中NO2的污染时,NO2与CO发生反应的热化学反应方程式为______________。
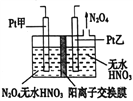
(3)工业废气中含有的NO2还可用电解法消除。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图所示。Pt乙为_______极,电解池中生成N2O5的电极反应式是_________。
【答案】 0.013mol/(L·min) 40% cd 向左 0.14 4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=-(a-b+2c)kJ·mol-1 阴 N2O4+2HNO3-2e-=2N2O5+2H+
【解析】(1)本题考查化学反应速率的计算、转化率的计算、影响化学平衡的因素以及化学平衡常数的计算,①根据化学反应速率的数学表达式,v(N2)=0.2/15mol/(L·min)=0.13mol/(L·min),0-15min,消耗CO的物质的量为(1.2-0.8)×2mol=0.8mol,即消耗NO的物质的量为0.8mol,则NO的转化率为0.8/2×100%=40%;②20min达到平衡,CO浓度降低,平衡向正反应方向进行,a、缩小容器的体积,压强增大,虽然平衡向正反应方向移动,但CO的浓度增大,故a错误;b、增加CO的量,虽然平衡向正反应方向移动,但CO浓度增大,故b错误;c、此反应是放热反应,降低温度,平衡向正反应方向移动,CO浓度降低,故c正确;d、扩大容器的体积,虽然平衡向逆反应方向移动,但组分的浓度降低,故d正确;③
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始浓度: 1 1.2 0 0
变化浓度: 0.4 0.4 0.4 0.2
平衡浓度: 0.6 0.8 0.4 0.2 根据平衡常数的定义,K= ,代入数值,解得K=0.14,达到平衡后再通入NO、N2各0.4mol,此时氮气的浓度为0.4mol,NO的浓度为0.8mol,其余不变,代入Qc=
,代入数值,解得K=0.14,达到平衡后再通入NO、N2各0.4mol,此时氮气的浓度为0.4mol,NO的浓度为0.8mol,其余不变,代入Qc= ,解得Qc=0.16>0.14,说明平衡向左进行,化学平衡常数只受温度的变化,温度不变,化学平衡常数不变,即此时平衡常数仍为0.14;(2)考查热化学反应方程式的书写,CO的燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g) △H=-2ckJ·mol-1…①,2NO(g)+O2(g)=2NO2(g) △H=-bkJ·mol-1…②,2NO(g)+2CO(g)=2CO2(g)+N2(g) △H=-akJ·mol-1…③,NO2与CO反应方程式为4CO+2NO2=N2+4CO2,依据盖斯定律,①+③-②得出4CO(g)+2NO2(g)=N2(g)+4CO2(g) △H=-(a-b+2c)kJ·mol-1;(3)考查电解原理的应用,Pt乙电极上产生N2O4,N2O4中N为+4价,HNO3中N显+5价,N的化合价降低,因此Pt乙为阴极;生成N2O5的电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+。
,解得Qc=0.16>0.14,说明平衡向左进行,化学平衡常数只受温度的变化,温度不变,化学平衡常数不变,即此时平衡常数仍为0.14;(2)考查热化学反应方程式的书写,CO的燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g) △H=-2ckJ·mol-1…①,2NO(g)+O2(g)=2NO2(g) △H=-bkJ·mol-1…②,2NO(g)+2CO(g)=2CO2(g)+N2(g) △H=-akJ·mol-1…③,NO2与CO反应方程式为4CO+2NO2=N2+4CO2,依据盖斯定律,①+③-②得出4CO(g)+2NO2(g)=N2(g)+4CO2(g) △H=-(a-b+2c)kJ·mol-1;(3)考查电解原理的应用,Pt乙电极上产生N2O4,N2O4中N为+4价,HNO3中N显+5价,N的化合价降低,因此Pt乙为阴极;生成N2O5的电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+。

【题目】草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为___________(填字母序号)。
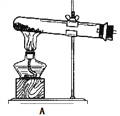

![]()

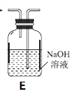
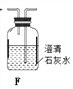
(2)相同温度条件下,分别用3支试管按下列要求完成实验:
试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
褪色时间 | 28秒 | 30秒 | 不褪色 |
写出试管B的离子方程式_____________________________________;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快”?____________(选填“能”或“不能”);简述你的理由:__________________________________。
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____________(填序号)。
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH >7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH< a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.00mL。
①所用指示剂为_______________;滴定终点时的现象为_________________________;
②H2C2O4溶液物质的量浓度为_______________;
③下列操作会引起测定结果偏高的是__________(填序号)。
A. 滴定管在盛装NaOH溶液前未润洗
B. 滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C. 滴定前读数正确,滴定终点时俯视读数
D. 滴定前读数正确,滴定终点时仰视读数