题目内容
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
则CO(g)+2H2(g)![]() CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。
(2)一定压强下,在容积为2 L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
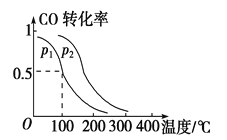
① 下列说法正确的是____________
A.若容器内气体密度恒定,反应达到平衡状态
B.若容器内各气体浓度恒定,反应达到平衡状态
C.上述反应中,ΔH > 0
D.反应中,催化剂使平衡向正反应方向移动
② p2 p1 (填“大于”、“小于”或“等于”);
③ 100 ℃时,该反应的化学平衡常数K=____ ____;
(3)某科研小组用SO2为原料制取硫酸。
① 利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:___________________。
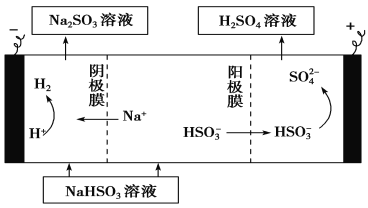
② 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式____________________________。
【答案】(1)2ΔH3+ΔH2-ΔH1
(2)①B、大于②4(mol/L)-2
(3)①SO2+2H2O-2e-=SO![]() +4H+②HSO
+4H+②HSO![]() +H2O-2e-=SO
+H2O-2e-=SO![]() +3H+
+3H+
【解析】
试题分析:(1)已知:①CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1 kJ·mol-1;
②CO(g)+1/2O2(g)=CO2(g) ΔH2 kJ·mol-1;
③H2(g)+1/2O2(g)=H2O(l) ΔH3 kJ·mol-1。
根据盖斯定律:②+③×2-①得则CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
ΔH=2ΔH3+ΔH2-ΔH1 kJ·mol-1。
(2)① A.随着反应的进行,容器内气体的质量保持不变,容器的容积保持不变,密度不随反应的进行而变化,若容器内气体密度恒定,不能说明反应达到平衡状态,错误;B.若容器内各气体浓度恒定,反应达到平衡状态,正确;C.分析图像知,升高温度,CO的平衡转化率减小,平衡逆向移动,则上述反应中,ΔH < 0 ,错误;D.反应中,催化剂,平衡不移动,错误,选B;②由图像可知,温度相同时,在压强为P2时平衡时CO的转化率高,由反应CO(g)+2H2(g)![]() CH3OH(g)可知压强越大,越有利于平衡向正反应进行,故压强p2大于p1;③利用三行式计算。100℃时,
CH3OH(g)可知压强越大,越有利于平衡向正反应进行,故压强p2大于p1;③利用三行式计算。100℃时,
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L)0.5 1 0
转化浓度(mol/L)0.25 0.5 0.25
平衡浓度(mol/L)0.25 0.5 0.25
该反应的化学平衡常数K=c(CH3OH)/c2(H2)c(CO)=4 (mol/L) - 2。
(3)①该原电池中,负极上二氧化硫失电子被氧化生成硫酸,利用氢离子和水配平电荷和原子,负极上的电极反应式为SO2+2H2O-2e-=SO![]() +4H+。②电解池中阳极和电源正极相连,亚硫酸氢根失去电子,发生氧化反应生成硫酸,利用氢离子和水配平电荷和原子,阳极电极反应式是HSO
+4H+。②电解池中阳极和电源正极相连,亚硫酸氢根失去电子,发生氧化反应生成硫酸,利用氢离子和水配平电荷和原子,阳极电极反应式是HSO![]() +H2O-2e-=SO
+H2O-2e-=SO![]() +3H+。
+3H+。