题目内容
用KMnO4与足量浓度为12mol/L的浓盐酸反应,反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
回答下列问题:
(1)2molKMnO4的质量为多少?
(2)2molKMnO4能氧化的HCl物质的量为多少?
(3)产生的Cl2在标准状况下的体积为多少?
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
回答下列问题:
(1)2molKMnO4的质量为多少?
(2)2molKMnO4能氧化的HCl物质的量为多少?
(3)产生的Cl2在标准状况下的体积为多少?
(1)2molKMnO4的质量=2mol×158g/mol=316g,
答:2molKMnO4的质量为316g;
(2)根据反应方程式的系数关系可知,2molKMnO4完全反应生成氯气的物质的量为5mol,被氧化的HCl生成氯气,根据氯原子守恒可知被氧化的HCl的物质的量是氯气的2倍,即被氧化的HCl的物质的量=5mol×2=10mol,
答:被氧化的HCl为10mol;
(3)标况下,生成氯气的体积=5mol×22.4L/mol=112L,
答:生成氯气的体积为112L.
答:2molKMnO4的质量为316g;
(2)根据反应方程式的系数关系可知,2molKMnO4完全反应生成氯气的物质的量为5mol,被氧化的HCl生成氯气,根据氯原子守恒可知被氧化的HCl的物质的量是氯气的2倍,即被氧化的HCl的物质的量=5mol×2=10mol,
答:被氧化的HCl为10mol;
(3)标况下,生成氯气的体积=5mol×22.4L/mol=112L,
答:生成氯气的体积为112L.

练习册系列答案
相关题目
 +HO-NO2
+HO-NO2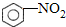 +H2O
+H2O