题目内容
Cu和浓HNO3反应时,若转移0.1mol电子,则被氧化的Cu是( )
| A.3.2g | B.6.4克 | C.0.05mol | D.0.005mol |
反应方程式为Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,反应中Cu被氧化,化合价由0价升高到+2价,
则Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O 转移电子
1mol 2mol
n0.1mol
n=0.05mol,
m(Cu)=0.05mol×64g/mol=3.2g,
故选A.
则Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O 转移电子
1mol 2mol
n0.1mol
n=0.05mol,
m(Cu)=0.05mol×64g/mol=3.2g,
故选A.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
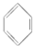 ⑥
⑥ ⑦
⑦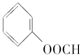 ⑧CH3OH ⑨HCOOH
⑧CH3OH ⑨HCOOH