题目内容
【题目】下列说法中不正确的是
A.生铁是铁的一种合金
B.合金是混合物
C.一般地说合金的熔点比它的各成分金属的熔点都高
D.铝制餐具不宜用来蒸煮或长期存放酸性或碱性食物
【答案】C
【解析】
A. 生铁是铁和碳的一种合金,故A正确;
B. 合金是一种金属与其它金属或非金属熔合而成的混合物,故B正确;
C. 一般地说合金的熔点比它的各成分金属的熔点都低,硬度比成分金属的大,故C错误;
D. 铝与酸、碱都能反应放出氢气,铝制餐具不宜用来蒸煮或长期存放酸性或碱性食物,故D正确。
答案选C。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】Ⅰ.氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分化学平衡常数K的值。
反应 | 大气固氮N2(g)+O2(g)2NO(g) | 工业固氮N2(g)+3H2(g)2NH3(g) | |||
温度/℃ | 27 | 2 000 | 25 | 400 | 450 |
平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因:____________________________。
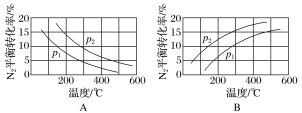
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较p1、p2的大小关系:________。
Ⅱ.目前工业合成氨的原理是N2(g)+3H2(g)2NH3(g)。
(3)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol。
①达平衡时,H2的转化率α1=________。
②已知平衡时,容器压强为8 MPa,则平衡常Kp=________(用平衡分压代替浓度计算,分压=总压×物质的量分数)。
【题目】某实验小组研究溶液中AgNO3和Na2S的反应。
实验 | 试剂 | 现象 | |
| 试管 | 滴管 | |
(pH = 4) |
(pH = 9) | 出现黑色沉淀 | |
(1)用离子方程式解释Na2S溶液pH > 7的原因:________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为![]() 和
和![]() ;
;
ii.Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。
① 设计并实施如下实验,证实沉淀中含有Ag2S。

试剂1和试剂2分别是_________、_________。
现象1和现象2分别是_________、_________。
② 设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作和现象补充完整。
实验操作 | 实验现象 | |
步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀,____________ | ____________ |
③ 经检验,沉淀不含有Ag。

(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如右图所示),测得电压为a(![]() )。
)。
对AgNO3溶液中氧化![]() 的物质进行推测:
的物质进行推测:
假设1: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() ;
;
假设2: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() 。
。
利用右图装置继续研究(已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
① 将![]() 的AgNO3溶液替换为_______溶液,记录电压为b(
的AgNO3溶液替换为_______溶液,记录电压为b(![]() )。
)。
② 上述实验证实了氧化![]() 的物质中一定包含
的物质中一定包含![]() ,其证据是______。
,其证据是______。
实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。