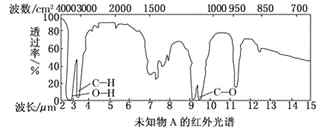
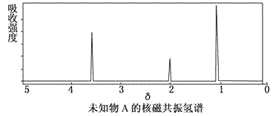
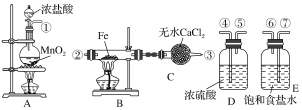
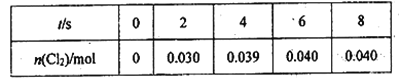
题目内容
【题目】分析、归纳、探究是学习化学的重要方法和手段之一。下面就电解质A回答有关问题 (假定以下都是室温时的溶液)。
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a
①当a =10时,A溶液呈碱性的原因是(用离子方式程式表示)___________________。
②当a =11,n =1时,A溶液中各种离子浓度由大到小的顺序为_____________________, c(OH-)-c(HB)=________ mol/L。
③当n=1、c=0.1,溶液中c(HB)∶c(B-)=1∶999时,A溶液的pH为______(保留整数值)。
(2)已知难溶电解质A的化学式为XY2,测得其饱和溶液中X2+离子的浓度为c mol/L,则该难溶物XY2的溶度积常数为Ksp=_______。
【答案】 Bn-+H2O![]() HB(n-1)-+OH- c(Na+)>c(B-)>c(OH-)>c(H+) 1×10-11 10 4c3
HB(n-1)-+OH- c(Na+)>c(B-)>c(OH-)>c(H+) 1×10-11 10 4c3
【解析】(1)①NanB溶液的pH=10,NanB为强碱弱酸盐,在溶液中发生水解,溶液显碱性,水解方程式为Bn-+H2O![]() HB(n-1)-+OH-;②当a=11,n=1时,由于B-离子水解,溶液显碱性,溶液中B-离子浓度减小,所以A溶液中各种离子浓度由大到小的顺序为c(Na+)>c(B-)>c(OH-)>c(H+);由电荷守恒可得:c(B-)+c(OH-)=c(H+)+c(Na+),由物料守恒可知:c(Na+)=c(HB)+c(B-),将钠离子浓度带入电荷守恒可得:c(B-)+c(OH-)=c(H+)+c(HB)+c(B-),c(OH-)-c(HB)=c(H+)=1×10-11;③n=1、c=0.1,c(HB)∶c(B-)=1∶999,说明参与水解的B-离子为0.1%,水解生成的氢氧根离子浓度为:0.1mol/L×0.1%=0.0001mol/L,则溶液的pH为10;(2)已知难溶电解质A的化学式为XY2,测得其饱和溶液中X2+离子的浓度为c mol/L,则Y-浓度是2c mol/L,因此该难溶物XY2的溶度积常数为Ksp=c×(2c)2=4c3。
HB(n-1)-+OH-;②当a=11,n=1时,由于B-离子水解,溶液显碱性,溶液中B-离子浓度减小,所以A溶液中各种离子浓度由大到小的顺序为c(Na+)>c(B-)>c(OH-)>c(H+);由电荷守恒可得:c(B-)+c(OH-)=c(H+)+c(Na+),由物料守恒可知:c(Na+)=c(HB)+c(B-),将钠离子浓度带入电荷守恒可得:c(B-)+c(OH-)=c(H+)+c(HB)+c(B-),c(OH-)-c(HB)=c(H+)=1×10-11;③n=1、c=0.1,c(HB)∶c(B-)=1∶999,说明参与水解的B-离子为0.1%,水解生成的氢氧根离子浓度为:0.1mol/L×0.1%=0.0001mol/L,则溶液的pH为10;(2)已知难溶电解质A的化学式为XY2,测得其饱和溶液中X2+离子的浓度为c mol/L,则Y-浓度是2c mol/L,因此该难溶物XY2的溶度积常数为Ksp=c×(2c)2=4c3。