题目内容
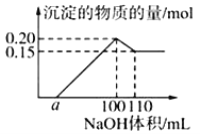
【题目】某实验小组对一含有Al3+的未知溶液进行分析:往该溶液逐滴滴加某浓度NaOH溶液,所加NaOH溶液体积(ml)与产生沉淀的物质的量(mol)的关系如下图所示:下列说法错误的是( )
A.该未知溶液中至少含有3种阳离子
B.滴加的NaOH溶液的物质的量浓度为5 molL﹣1
C.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
D.若溶液中仅有两种金属阳离子,且另一种离子为二价阳离子,则a=10
【答案】C
【解析】
试题分析:A、0~a没有沉淀产生,说明含有H+,有沉淀产生,NaOH过量时沉淀溶解,但未完全溶解,说明原溶液中含有Al3+、Mg2+(Fe3+)等,因此至少含有3种阳离子,A正确;B、根据100~110间发生反应:Al(OH)3+OH-=AlO2-+2H2O,因此消耗的NaOH的物质的量为(0.2-0.15)mol=0.05mol,因此NaOH的浓度c(NaOH)=0.05/10×10-3mol·L-1=5mol·L-1,B正确; C、因为不能确定最终沉淀中金属价态,因此无法计算,C错误;D、根据图像n(Mg2+)=0.15mol,n(Al3+)=(0.2-0.15)mol=0.05mol,Mg2+消耗氢氧化钠的体积为60mL,Al3+消耗的氢氧化钠的体积为30mL,则a=100-(60+30)mL=10mL,D正确;答案选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目