题目内容
13.下列各组中的性质比较,正确的是( )| A. | 酸性HClO4>HBrO4>HIO4 | B. | 碱性NaOH>Mg(OH)2>Ca(OH)2 | ||
| C. | 稳定性:HI>H2S>HCl | D. | 氧化性:Na+>Mg2+>Al3+ |
分析 A、Cl、Br、I位于同一主族,同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物的水化物的酸性逐渐减弱;
B、同周期从左到右金属性减弱,同主族元素的金属性从上到下逐渐增强,对应的最高价氧化物的水化物的进行逐渐减弱;
C、非金属性越强,对应的氢化物越稳定;
D、金属性越强对应离子的氧化性越弱.
解答 解:A、Cl、Br、I位于同一主族,同主族元素从上到下元素的非金属性逐渐减弱,所以酸性:HClO4>HBrO4>HIO4,故A正确;
B、金属性Ca>Na>Mg,但氢氧化钙微溶,所以碱性NaOH>Ca(OH)2>Mg(OH)2,故B错误;
C、非金属性:Cl>S>I,所以稳定性:HCl>H2S>HI,故C错误;
D、金属性越强对应离子的氧化性越弱,金属性Na>Mg>Al,所以氧化性:Na+<Mg2+<Al3+,故D错误;
故选A.
点评 本题考查元素周期表的递变规律,题目难度不大,注意单质、化合物的性质与金属性、非金属性的关系.

练习册系列答案
相关题目
18.每年6月5日为“世界环境日”,今年“六•五”“世界环境日”中国主题为“同呼吸 共奋斗”,旨在每一个公民都应尊重自然,顺应自然,增强节约意识、环保意识、生态意识,养成健康合理的生活方式和消费模式,激发全社会持久的环保热情,为改善空气质量、实现天蓝、地绿、水净的美丽中国而奋斗.下列不符合这一主题的是.( )
| A. | 建立合法、公开的地沟油回收生产制度,将生产的地沟油用作工业用油 | |
| B. | 将生活垃圾分类回收,加工、使之再生、再利用 | |
| C. | 生活污水、工业废水不要乱排放,通过打深井,将之排到地层深处 | |
| D. | 不用一次性筷子、不浪费纸张、不浪费粮食、做“光盘”一族 |
19. 科学家预言,燃料电池将是 21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许 H+ 和水分子通过.其工作原理的示意图如下.下列说法错误的是( )
科学家预言,燃料电池将是 21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许 H+ 和水分子通过.其工作原理的示意图如下.下列说法错误的是( )
 科学家预言,燃料电池将是 21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许 H+ 和水分子通过.其工作原理的示意图如下.下列说法错误的是( )
科学家预言,燃料电池将是 21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许 H+ 和水分子通过.其工作原理的示意图如下.下列说法错误的是( )| A. | a 是负极,b 是正极 | |
| B. | b 极的电极反应是 O2+4H++4e-═2H2O | |
| C. | 放电过程中,电子流动方向为:a→b→质子交换膜→a | |
| D. | 当电路上通过 2 mol 电子消耗的 CH3OH 为 $\frac{1}{3}$mol |
8.设NA为阿伏加德罗常数,下列有关说法正确的是( )
| A. | 常温下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5 mol苯分子中含有C=C双键数为1.5 NA | |
| C. | 1 mol甲基(-CH3)所含的电子总数为10 NA | |
| D. | 标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为$\frac{{N}_{A}}{22.4}$ |
2.下列关于有机物的说法正确的是( )
| A. | 蛋白质和葡萄糖在一定条件下完全燃烧都只生成CO2和水 | |
| B. | 75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 石油的分馏和煤的干馏均属于物理变化 | |
| D. | 乙烯和苯都能使溴水褪色,褪色的原因相同 |
3.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下).它在光照的条件下与氯气反应能生成三种不同的一氯取代物.该烃的结构简式可能是( )
| A. | 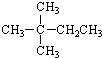 | B. |  | C. | CH3CH2CH2CH2CH3 | D. | CH3CH2CH2CH3 |