题目内容
18.标准状况下将35mL气态烷烃完全燃烧,恢复到原来状况下,得到二氧化碳气体140mL,则该烃的分子式为( )| A. | C5H12 | B. | C4H10 | C. | C3H6 | D. | C3H8 |
分析 根据同温同压下,体积比等于物质的量之比,再根据碳原子守恒计算出碳原子数,最后根据烷烃的通式确定该烷烃的分子式.
解答 解:标准状况下,35mL气态烷烃完全燃烧时,恢复到原来状况下,可得到140mL二氧化碳气体,
相同条件下,气体的物质的量之比等于其体积之比,则根据碳原子守恒可知该烷烃分子中含碳原子数为:=4,
所以烷烃的分子式为:C4H10,
故选B.
点评 本题考查了烷烃分子式的确定,题目难度不大,根据相同条件下气体体积比等于物质的量之比计算出碳原子是解题关键,注意明确质量守恒在确定有机物分子式中的应用方法.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
8.设NA为阿伏加德罗常数,下列有关说法正确的是( )
| A. | 常温下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5 mol苯分子中含有C=C双键数为1.5 NA | |
| C. | 1 mol甲基(-CH3)所含的电子总数为10 NA | |
| D. | 标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为 |
9.下列说法正确的是( )
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
6.下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述正确的是( )
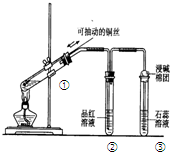

| A. | 上下移动①中铜丝可控制SO2的量 | |
| B. | ②中品红溶液不褪色 | |
| C. | ③中石蕊溶液变蓝色 | |
| D. | 为确认CuSO4生成,向①中加水,观察溶液颜色 |
3.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下).它在光照的条件下与氯气反应能生成三种不同的一氯取代物.该烃的结构简式可能是( )
| A. | 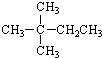 | B. |  | C. | CH3CH2CH2CH2CH3 | D. | CH3CH2CH2CH3 |
7.向体积为 Va 的0.05mol•L-1CH3COOH溶液中加入体积为Vb的0.05mol•L-1KOH溶液,下列关系错误的是( )
| A. | Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+) | |
| B. | Va=Vb时:c(CH3COOH)+c(H+)>c(OH-) | |
| C. | Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+) | |
| D. | Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
8.下列有关化学反应速率和限度的说法中,正确的是( )
| A. | 决定反应速率的因素是反应物的浓度 | |
| B. | 在金厲钠与足量水反应中,增加水的量能加快反应速率 | |
| C. | 在可逆反应中,反应物不可能完全转化为生成物 | |
| D. | 可逆反应达到平衡时,正、逆反应速率相等且等于零 |