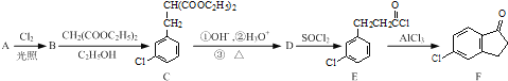
题目内容
【题目】下列说法正确的是( )
A.某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷
B.等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等
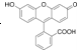
C.如图是某有机物分子的比例模型,该物质可能是一种氨基酸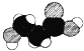
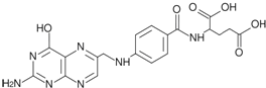
D.化合物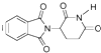 在酸性条件下水解,所得溶液加碱后加热有NH3生成
在酸性条件下水解,所得溶液加碱后加热有NH3生成
【答案】D
【解析】
A.2,2,4,4-四甲基-3,3,5-三乙基己烷,最长碳链应为7,正确命名应该为2,2,4,4,5-五甲基-3,3-二乙基庚烷,A错误;
B.甲醛最简式CH2O,乳酸的最简式为CH2O,所以等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量相等,B错误;
C.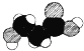 ,该模型中出现三种元素,应为羟基丙酸,不是氨基酸,C错误;
,该模型中出现三种元素,应为羟基丙酸,不是氨基酸,C错误;
D.化合物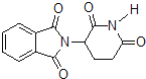 在酸性条件下水解产物中含有铵离子,然后在碱性溶液中加热,铵离子与氢氧根离子反应生成氨气,D正确;
在酸性条件下水解产物中含有铵离子,然后在碱性溶液中加热,铵离子与氢氧根离子反应生成氨气,D正确;
答案选D。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】NO和CO都是汽车排放尾气中的有害物质,需要进一步处理和利用。
(1)已知:CO可将部分氮的氧化物还原为N2。
反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1
N2(g)+2CO2(g) △H = -746 kJ·mol-1
反应Ⅱ:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H = -1200 kJ·mol-1
N2(g)+4CO2(g) △H = -1200 kJ·mol-1
写出CO将NO2还原为NO的热化学方程式__________________。
(2)在密闭容器中充入5 mol CO和4 mol NO,发生上述反应I,如图为平衡时NO的体积分数与温度、压强的关系。

回答下列问题:
①温度:T1_________T2(填“<”或“>”)。
②某温度下,在体积为2 L的密闭容器中,反应进行10分钟放出热量373 kJ,用CO的浓度变化表示的平均反应速率v(CO)=_____________。图中A~G点中,正反应速率最快的是______点(填序号)
③某温度下,反应达到平衡状态D点时,容器体积为2 L,此时的平衡常数K =_____(结果精确到0.01);
(3)工业上可以利用CO与H2反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H。若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
CH3OH(g) △H。若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入量 | 反应物的转化率 | CH3OH的浓度(mol/L) | 能量变化(Q1、Q2、Q3均大于0) |
1 | 1molCO和2molH2 | a1% | c1 | 放出Q1KJ热量 |
2 | 1molCH3OH | a2% | c2 | 吸收Q2KJ热量 |
3 | 2molCO和4molH2 | a3% | c3 | 放出Q3KJ热量 |
①该反应的△H为_________;(用带Q1、Q2或Q3的式子表示)
②下列关系一定正确的是(______)
A. c1= c2 B. a1 >a3 C.a1=a2 D. 2Q1 < Q3