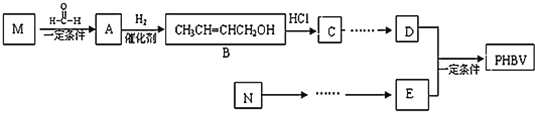
��Ŀ����
����Ŀ��ClO2��һ�ָ�Ч��ȫ��ɱ������������ҵ�Ͽ��ڽϴ��ѹ�µ���Ȼ����ȵõ�NaClO3���Ʊ�ClO2���乤��ԭ��ʾ��ͼ��ͼ������˵����ȷ����( )
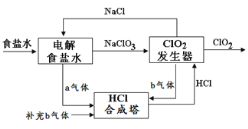
A.a������������b����������
B.��װ�����Ȼ��Ƶ��������ĵ缫����ʽΪ��2Cl- - 2e- = Cl2��
C.ClO2�������з����ķ�Ӧ��2ClO3- + 4H+ + 2Cl-=2ClO2�� + Cl2�� +2H2O
D.Ϊʹa��b����ǡ����ȫ��Ӧ��������ÿ����1mol ClO2��Ҫ����44.8L b����(��״��)
���𰸡�C
��������
A. ����Ȼ��Ʒ���ʽΪNaCl+3H2O![]() NaClO+3H2������a������������b������������A����
NaClO+3H2������a������������b������������A����
B. ��װ�����Ȼ��Ƶ��������ĵ缫����ʽΪ��Cl- - 6e-+3H2O= ClO3-+6H+��B����
C. ClO2��������ClO3- ��Cl-��������Һ�з�����Ӧ������ClO2�� Cl2��H2O��C��ȷ��
D. �ɷ�ӦNaCl+3H2O![]() NaClO+3H2����2NaClO3 + 4HCl=2ClO2�� + Cl2�� +2NaCl+2H2O��������ÿ����1mol ClO2��Ҫ����56L b����(��״��)��D����
NaClO+3H2����2NaClO3 + 4HCl=2ClO2�� + Cl2�� +2NaCl+2H2O��������ÿ����1mol ClO2��Ҫ����56L b����(��״��)��D����
��ѡC��

��ϰ��ϵ�д�
�����Ŀ