��Ŀ����
����Ŀ��NO��CO���������ŷ�β���е��к����ʣ���Ҫ��һ�����������á�
(1)��֪��CO�ɽ����ֵ��������ﻹԭΪN2��
��Ӧ��2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
��Ӧ��4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
д��CO��NO2��ԭΪNO���Ȼ�ѧ����ʽ__________________��
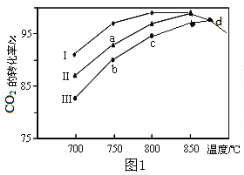
(2)���ܱ������г���5 mol CO��4 mol NO������������ӦI����ͼΪƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ��

�ش��������⣺
���¶ȣ�T1_________T2(����������������)��
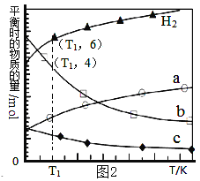
��ij�¶��£������Ϊ2 L���ܱ������У���Ӧ����10���ӷų�����373 kJ����CO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(CO)=_____________��ͼ��A~G���У�����Ӧ����������______��(�����)
��ij�¶��£���Ӧ�ﵽƽ��״̬D��ʱ���������Ϊ2 L����ʱ��ƽ�ⳣ��K =_____(�����ȷ��0.01)��
(3)��ҵ�Ͽ�������CO��H2��Ӧ�ϳɼ״���CO(g)+2H2(g)![]() CH3OH(g) ��H�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ��ʱ���й��������±���
CH3OH(g) ��H�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ��ʱ���й��������±���
���� | ��Ӧ��Ͷ���� | ��Ӧ���ת���� | CH3OH��Ũ��(mol/L) | �����仯(Q1��Q2��Q3������0) |
1 | 1molCO��2molH2 | a1% | c1 | �ų�Q1KJ���� |
2 | 1molCH3OH | a2% | c2 | ����Q2KJ���� |
3 | 2molCO��4molH2 | a3% | c3 | �ų�Q3KJ���� |
�ٸ÷�Ӧ����HΪ_________��(�ô�Q1��Q2��Q3��ʽ�ӱ�ʾ)
�����й�ϵһ����ȷ������______��
A. c1= c2 B. a1 >a3 C.a1=a2 D. 2Q1 < Q3
���𰸡�CO(g)+NO2(g)==CO2(g)+NO(g) H=-227 kJ/mol > 0.05 molL-1min-1 C 0.22 Lmol-1 -(Q1+Q2) AD
��������
(1)��Ӧ����2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
��Ӧ����4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
��(��Ӧ��-��Ӧ��)��2������CO��NO2��ԭΪNO���Ȼ�ѧ����ʽ��
(2)������ӦΪ���ȷ�Ӧ������ͬѹǿ�£������¶ȣ�ƽ�������ƶ�������NO�������������ȷ��T1��T2�Ĺ�ϵ��
��373 kJΪ746��һ�룬��μӷ�Ӧ��COΪ1mol����CO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(CO)=![]() ��ͼ��A~G���У����¶Ⱥ�ѹǿ��������ȷ������Ӧ�������ĵ㡣
��ͼ��A~G���У����¶Ⱥ�ѹǿ��������ȷ������Ӧ�������ĵ㡣
��ij�¶��£���Ӧ�ﵽƽ��״̬D��ʱ���������Ϊ2 L����������ʽ�����ƽ��ʱ��Ӧ�����������Ũ�ȣ��Ӷ����ƽ�ⳣ��K��
(3)������1������Ӧ��ʼ������2���淴Ӧ��ʼ��ƽ��ʱ���ߵ�Ч���ɴ˿�ȷ���÷�Ӧ�ġ�H��
�ڽ�ϵ�Чƽ��˼����з�����
(1)��Ӧ����2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
��Ӧ����4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
��(��Ӧ��-��Ӧ��)��2������CO��NO2��ԭΪNO���Ȼ�ѧ����ʽΪCO(g)+NO2(g)==CO2(g)
+NO(g) H=-227 kJ/mol������CO(g)+NO2(g)==CO2(g)+NO(g) H=-227 kJ/mol��
(2)������ӦΪ���ȷ�Ӧ������ͬѹǿ�£������¶ȣ�ƽ�������ƶ���T1ʱ��NO����������Ӷ�ȷ��T1>T2����Ϊ��>��
��373 kJΪ746��һ�룬��μӷ�Ӧ��COΪ1mol����CO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(CO)=![]() = 0.05 molL-1min-1����ǰ�������T1���¶ȸߣ���C��ѹǿ����¶��ָߣ���������Ӧ�������ĵ�ΪC�㡣��Ϊ��0.05 molL-1min-1��C��
= 0.05 molL-1min-1����ǰ�������T1���¶ȸߣ���C��ѹǿ����¶��ָߣ���������Ӧ�������ĵ�ΪC�㡣��Ϊ��0.05 molL-1min-1��C��
����CO�ı仯��Ϊ2x��������ʽΪ��
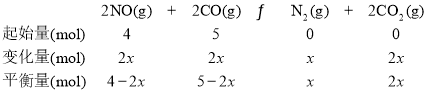
![]() ��x=1mol��K=
��x=1mol��K=![]() =0.22������0.22��
=0.22������0.22��
(3)������1������Ӧ��ʼ������2���淴Ӧ��ʼ��ƽ��ʱ���ߵ�Ч���ɴ˿�ȷ���÷�Ӧ�ġ�H= -(Q1+Q2)KJ/mol����Ϊ��-(Q1+Q2) KJ/mol��
��A. ����1������2��ƽ��Ϊ��Чƽ�⣬��c1= c2��A��ȷ��
B.����3�൱������1ѹ���������Ϊԭ���Ķ���֮һ����ƽ�������ƶ���a1 <a3��B����
C. ����1������2��ƽ��Ϊ��Чƽ�⣬��Ӧ���ת���ʲ�һ��Ϊ50%������a1��a2��һ����ȣ�C����
D. ����3�൱������1ѹ���������Ϊԭ���Ķ���֮һ����ƽ�ⲻ�ƶ�����

����Ŀ������ʵ��������������۲���ȷ��( )
ѡ�� | ʵ�鲽�� | ���� | ���� |
A | �����Ը��������Һ�еμӲ�����Һ | ��Һ��ɫ | ������л�ԭ�� |
B | ��Na2CrO4��Һ�еμӹ���Ũ���� | ��Һ�ɻ�ɫת��Ϊ�Ȼ�ɫ | CrO42-��������������ȫתΪCr2O72- |
C | װ��NO2����ƿ������ˮ�� | ��ƿ����ɫ���� | �����¶ȣ�ƽ��2NO2 |
D | ��Na2S2O3��Һ�еμ�ϡ���� | �е���ɫ�������� | S2O32-��H+���ܹ��� |
A.AB.BC.CD.D
����Ŀ���״���Ϊ��������Դ��Խ��Խ�ܵ����ǵĹ�ע����֪�״��Ʊ����йػ�ѧ��Ӧ��ƽ�ⳣ�����ʱ���������
��ѧ��Ӧ | 500��ƽ�ⳣ�� | �ʱ� |
��CO(g)��2H2(g) | K1��2.5 | ��H1����116 kJ��mol��1 |
��CO2(g)��H2(g) | K2��1.0 | ��H2����41 kJ��mol��1 |
��CO2(g)��3H2(g) | K3���� | ��H3���� |
��1����Ӧ�۵�K3��__����H3��___��
��2�����ڷ�Ӧ�������¶�ƽ�ⳣ��___(�������С�����䡱)��
��3��500��ʱ��÷�Ӧ����ijʱ��CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ��(mol��L��1)�ֱ�Ϊ0.1��0.8��0.3��0.15�����ʱv��__v��(����>����<������)��