题目内容
【题目】Mg与Br2反应可生成具有强吸水性的MgBr2,该反应剧烈且放出大量热。实验室采用如图装置制备无水MgBr2。已知MgBr2+3C2H5OC2H5![]() MgBr23C2H5OC2H5,MgBr23C2H5OC2H5溶于乙醚。下列说法不正确的是( )
MgBr23C2H5OC2H5,MgBr23C2H5OC2H5溶于乙醚。下列说法不正确的是( )
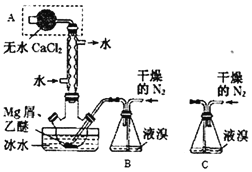
A.仪器A为干燥管,其主要作用是防止水蒸气进入反应装置
B.冷凝管的作用是导气兼起冷凝回流
C.装置B必须用干燥的N2而不能改用空气,但装置B可换成装置C
D.乙醚的作用是与MgBr2反应生成MgBr23C2H5OC2H5,并将其溶解而与Mg分离
【答案】C
【解析】
A.制备无水MgBr2,应避免接触水蒸气,则仪器A为干燥管,可防止水蒸气进入反应装置,故A正确;
B.冷凝管有利于液溴、乙醚充分反应,起到冷凝回流的作用,故B正确;
C.将装置B改为C装置,当干燥的氮气通入,会使气压变大,将液溴快速压入三颈瓶,反应过快大量放热存在安全隐患,装置B是利用干燥的氮气将溴蒸气带入三颈瓶中,反应可以容易控制防止反应过快,故C错误;
D.由题给信息可知MgBr23C2H5OC2H5溶于乙醚,则乙醚的作用是与MgBr2反应生成MgBr23C2H5OC2H5,并将其溶解而与Mg分离,故D正确。
故选:C。

【题目】甲醇作为可再生能源,越来越受到人们的关注。已知甲醇制备的有关化学反应的平衡常数及焓变数据如下
化学反应 | 500℃平衡常数 | 焓变 |
①CO(g)+2H2(g) | K1=2.5 | ΔH1=-116 kJ·mol-1 |
②CO2(g)+H2(g) | K2=1.0 | ΔH2=+41 kJ·mol-1 |
③CO2(g)+3H2(g) | K3=? | ΔH3=? |
(1)反应③的K3=__,ΔH3=___。
(2)对于反应②升高温度平衡常数___(填“增大”“减小”或“不变”)。
(3)500℃时测得反应③在某时刻CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.1、0.8、0.3、0.15,则此时v正__v逆(填“>”“<”或“=”)。