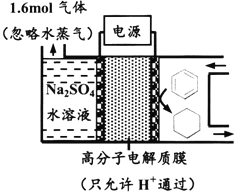
题目内容
【题目】实验室用如图装置制备并收集干燥纯净的Cl2。
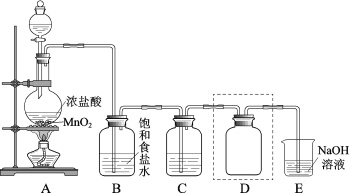
(1)装置A中反应的化学方程式是___。
(2)装置B的作用是__。
(3)装置C中盛放的物质是__。
(4)装置D用于收集Cl2,请将图中装置D的导气管补充完整___。
(5)装置E用于吸收尾气,E中反应的离子方程式是__。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 除去Cl2中混有的HCl 浓硫酸
MnCl2+Cl2↑+2H2O 除去Cl2中混有的HCl 浓硫酸  Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)装置A是用浓盐酸和二氧化锰在加热的条件下制取氯气的装置;
(2)装置B盛有饱和食盐水,用来除去氯气中的氯化氢气体;
(3)通过装置B出来的氯气中含有水,则装置C中盛放的物质是浓硫酸,除去氯气中的水分;
(4)装置D用于收集Cl2,氯气的密度比空气大,收集时,使用向上排空气法,集气瓶内的导管应长进短出;
(5)装置E盛有氢氧化钠用于吸收多余的氯气,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(1)装置A是用来制取氯气的装置,根据图示浓盐酸和二氧化锰在加热的条件下制取氯气,化学反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)由于盐酸具有挥发性,从装置A中出来的氯气中混有氯化氢气体,装置B盛有饱和食盐水,用来除去氯气中的氯化氢气体,
故答案为:除去Cl2中混有的HCl;
(3)通过装置B出来的氯气中含有水,则装置C中盛放的物质是浓硫酸,除去氯气中的水分,
故答案为:浓硫酸;
(4)装置D用于收集Cl2,氯气的密度比空气大,收集时,使用向上排空气法,集气瓶内的导管应长进短出,装置图为: ,
,
故答案为: ;
;
(5)装置E盛有氢氧化钠用于吸收多余的氯气,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;

 阅读快车系列答案
阅读快车系列答案【题目】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是5种元素的相关信息,W、X都位于第三周期。
元素 | 信息 |
Q | 地壳中含量最高的元素 |
W | 最高化合价为+7价 |
X | 最高价氧化物对应的水化物在本周期中碱性最强 |
Y | 焰色试验(透过蓝色钴玻璃)火焰呈紫色 |
Z | 原子结构示意图为: |
(1)Q在周期表中的位置是__。
(2)W的最高价氧化物对应的水化物的化学式是___。
(3)X单质与水反应的离子方程式是__。
(4)金属性Y强于X,用原子结构解释原因:__,失电子能力Y大于X,金属性Y强于X。
(5)下列对于Z及其化合物的推断中,正确的是__(填字母)。
A.Z的最低负化合价与W的最低负化合价相同
B.Z的氢化物的稳定性弱于W的氢化物的稳定性
C.Z的单质可与X和W形成的化合物的水溶液发生置换反应