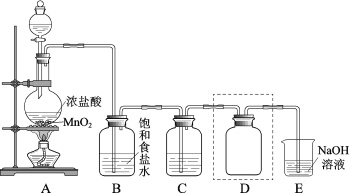
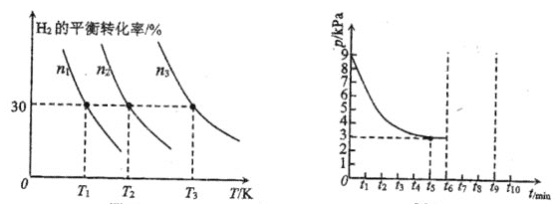
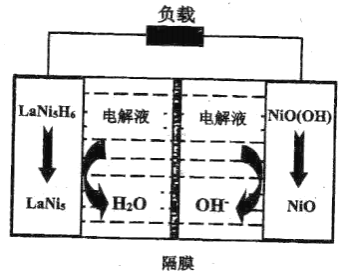
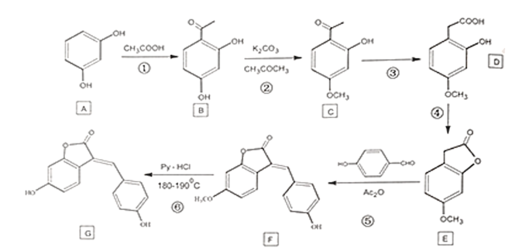
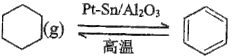题目内容
【题目】(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
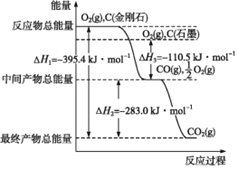
①在通常状况下,金刚石和石墨中____![]() 填“金刚石”或“石墨”
填“金刚石”或“石墨”![]() 更稳定,石墨的燃烧热为____。
更稳定,石墨的燃烧热为____。
②1mol金刚石不完全燃烧生成CO时放出的热量为____。
(2)50mL0.5molL-1的盐酸与50mL0.55molL-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
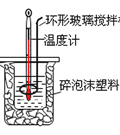
用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会___;用NaOH固体进行上述实验,测得的中和热会___![]() 均填“偏大”“偏小”“无影响”
均填“偏大”“偏小”“无影响”![]()
【答案】石墨 393.5kJmol-1 112.4kJ 偏小 偏小
【解析】
(1)①依据物质能量越高,物质越不稳定;依据图象判断石墨的燃烧热;
②依据金刚石完全燃烧放出的热量和中间产物的能量的差值计算金刚石不完全燃烧生成CO时放出的热量;
(2)NH3·H2O是一元弱碱,电离吸收热量,NaOH固体溶解会放出热量。
(1)①根据图象分析可知:金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为393.5kJmol-1;
②图象分析可得:①C(金刚石,s)+O2(g)=CO2(g) △H=-395.4kJmol-1;②CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJmol-1;根据盖斯定律,由①-②可得:C(金刚石,s)+
O2(g)=CO2(g) △H=-283.0kJmol-1;根据盖斯定律,由①-②可得:C(金刚石,s)+![]() O2(g)=CO(g) △H=-112.4kJmol-1;故1mol金刚石不完全燃烧生成CO时放出的热量为112.4kJ;
O2(g)=CO(g) △H=-112.4kJmol-1;故1mol金刚石不完全燃烧生成CO时放出的热量为112.4kJ;
(2)中和热是强酸和强碱反应生成1mol水时放出的热量;一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,使测得中和热的数值偏小;若用NaOH固体进行上述实验,NaOH固体溶解过程为放热过程,反应放出的热量偏多,反应放出的热量越多,中和热就越小,因此用NaOH固体进行上述实验,测得的中和热会偏小。

 53随堂测系列答案
53随堂测系列答案【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.158 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸
(2)在溶液配制过程中,下列操作正确且对配制结果没有影响的是__________。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(3)配制上述500mL“鲜花保鲜剂”所需的玻璃仪器有:烧杯、玻璃棒、_____________、__________。(在横线上填写所缺仪器的名称)
(4)鲜花保鲜剂中K+(蔗糖、阿司匹林中不含K+) 的物质的量浓度为______mol/L。