题目内容
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g) 在5 L的密闭容器中进行反应,30 min后,C的物质的量增加了 0.30 mol。下列叙述正确的是( )
4C(g)+6D(g) 在5 L的密闭容器中进行反应,30 min后,C的物质的量增加了 0.30 mol。下列叙述正确的是( )
A. 30 min中A的平均反应速率是0.010 mol·L-1·min-1
B. 容器中D的物质的量一定增加了0.45 mol
C. 容器中A、B、C、D的物质的量之比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加0.30 mol
【答案】B
【解析】试题分析:A、v(C)=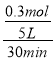 =0.002molL-1min-1,率之比等于化学计量数之比,所以v(A)=v(C)=0.002molL-1min-1,故A错;B、C的物质的量增加了0.30mol,根据方程式4A(g)+5B(g)
=0.002molL-1min-1,率之比等于化学计量数之比,所以v(A)=v(C)=0.002molL-1min-1,故A错;B、C的物质的量增加了0.30mol,根据方程式4A(g)+5B(g)![]() 4C(g)+6D(g)可知,生成D的物质的量为0.45mol,故B正确;C、30min后,容器中A、B、C、D的物质的量的比与物质的量投入的量及转化率有关,可能为4:5:4:6,可能不是,故C错误;D、C的物质的量增加了0.30mol,根据方程式4A(g)+5B(g)
4C(g)+6D(g)可知,生成D的物质的量为0.45mol,故B正确;C、30min后,容器中A、B、C、D的物质的量的比与物质的量投入的量及转化率有关,可能为4:5:4:6,可能不是,故C错误;D、C的物质的量增加了0.30mol,根据方程式4A(g)+5B(g)![]() 4C(g)+6D(g)可知,参加反应的A的物质的量为0.3mol,A减小0.3mol,故D错误;故选B。
4C(g)+6D(g)可知,参加反应的A的物质的量为0.3mol,A减小0.3mol,故D错误;故选B。

【题目】(1)双氧水能使酸性高锰酸钾溶液褪色,其反应的化学方程式如下,请将相关的化学计量数填写在方框里:_______□H2O2+□KMnO4+□H2SO4=□MnSO4+□K2SO4+□O2↑+□H2O
(2)某混合溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Mg2+、Al3+、NH4+、Fe3+ |
可能大量含有的阴离子 | Cl-、Br-、CO32-、AlO2- |
为探究其成分,进行了以下探究实验。
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠的体积(V)的关系如图所示。

①该溶液中一定含有的阳离子是____________,其对应的物质的量浓度之比为_________,一定不存在的阴离子是______________;
②请写出沉淀减少过程中发生反应的离子方程式____________________。

