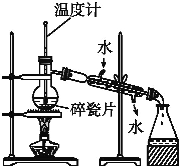
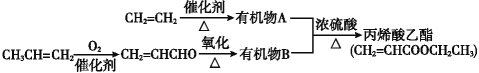
题目内容
【题目】X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是( )
A.原子序数:X<Y
B.原子半径:X<Y
C.离子半径:X>Y
D.最外层电子数:X<Y
【答案】D
【解析】解:X元素的阳离子与Y的阴离子具有相同的核外电子排布,则X元素为下一周期的金属元素,Y为上一周期的非金属元素,
A.原子序数为X>Y,故A错误;
B.电子层越多,半径越大,则原子半径为X>Y,故B错误;
C.具有相同电子层结构的离子,原子序数大的离子半径小,则离子半径为X<Y,故C错误;
D.X的最外层电子数少于4,Y的最外层电子数多于4个,则最外层电子数为X<Y,故D正确;
故选D.

 阅读快车系列答案
阅读快车系列答案【题目】
(1)I.已知:Na2S2O3 + H2 SO4=Na2SO4 + SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
①该实验①、②可探究温度对反应速率的影响,因此V1= , V2 = , V3=;
(2)②若V4=10.0,V5=6.0,则实验①、③可探究 对反应速率的影响。
(3)Ⅱ.利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可定量测定硫代硫酸钠(Mr=158)的纯度,现在称取wg硫代硫酸钠固体样品,配成250 mL的溶液,取25.00 mL置于锥形瓶中,加入指示剂,用a mol/L的碘水滴定,消耗碘水b mL,则:
①滴定应选择的指示剂是 , 滴定终点的现象为。
②对于该滴定实验的有关操作或误差分析正确的是。
A.滴定前,要用对应装入的溶液润洗滴定管和锥形瓶
B.滴定过程中,标准液滴到锥形瓶外,会使所测得的结果偏大
C.滴定开始时滴定管尖嘴有气泡,滴定结束后气泡消失,测得纯度将偏小
D.滴定前仰视读数而滴定结束时俯视读数,则所测得的纯度将会偏小
③样品中硫代硫酸钠纯度的表达式为。
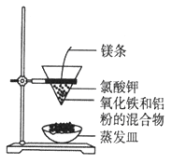
【题目】实验室按照图1所示装置制备氯酸钾、氯水并进行有关探究实验。
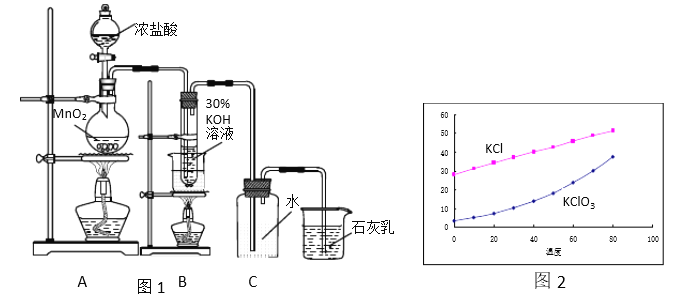
Ⅰ实验一 制取氯酸钾和氯水
(1)A中发生反应的化学方程式是_____________。
(2)制备KClO3需在70℃~80℃进行,写出制备KClO3的离子方程式______。
(3)装置C的作用是_____ 。
(4)KCl 和KClO3的溶解度如图2所示。反应结束后,将装置B中的溶液放到冰水浴中, 20秒后会析出较多晶体X。这样做是因为________(选填a、b、c):
a. KClO3溶解度受温度影响较大而KCl溶解度受温度影响较小
b. 0℃时,KClO3溶解度比KCl小
c. 溶液中的溶质主要是KClO3
所以在冷却过程中晶体X会沉淀析出,X的化学式是_______。
(5)上一步操作会不可避免地使另一种物质同时析出,因此要获得较纯净的X,需要进行的具体的操作步骤是_________________。
Ⅱ实验二 氯酸钾性质研究
(6)在不同条件下KClO3可将KI氧化为不同的产物。该小组设计了如下实验,研究反应条件对反应产物的影响(实验在室温下进行):
0.20 mol·L KI/ mL | KClO3(s) /g | 6.0 mol·L-1 H2SO4/ mL | 蒸馏水/ mL | |
试管1 | 1.0 | 0.10 | 0 | 9.0 |
试管2 | 1.0 | 0.10 | 3.0 | 6.0 |
①该实验的实验目的是__。
②设计试管1实验的作用是_____。
③实验后发现,试管2中产生黄色溶液,该同学预测KI被氧化为I2。用离子方程式表示该同学的预测____________;请设计2种实验方案验证该预测正确(从加入试剂、现象、结论等方面描述)______________。