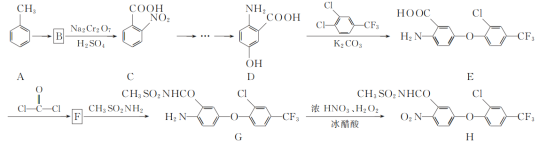
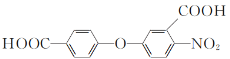
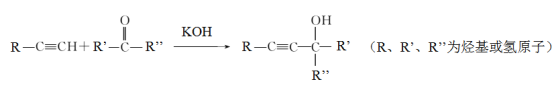题目内容
【题目】25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是________(填“强电解质”或“弱电解质”,下同),BOH是_______。
(2)HA的电离方程式是____________________________________。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/c(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体________(填“多”、“少”或“相等”)。
【答案】弱电解质; 强电解质 HAH++A- B 多
【解析】
(1)首先判断出溶液中氢离子或氢氧根离子浓度,然后结合酸碱的浓度判断电解质强弱;
(2)HA为弱电解质,在溶液中部分电离,存在电离平衡;
(3)根据稀释促进电离分析解答;
(4)等pH时,弱电解质的物质的量浓度大于盐酸的浓度,据此解答。
(1)25℃时,0.1molL-1的某酸HA中,如果该酸是强酸,氢离子浓度为0.1mol/L,氢氧根离子浓度为:10-13mol/L,则c(H+)/c(OH-)=1012>1010,所以该酸是弱酸;0.01molL-1的BOH溶液pH=12,溶液中氢氧根离子的浓度为0.01mol/L,说明BOH完全电离,属于强电解质;
(2)弱酸在水溶液里存在电离平衡,其电离方程式为HA![]() H++A-;
H++A-;
(3)A.加水稀释促进了弱酸的电离,溶液中氢离子的物质的量增大,HA的物质的量减小,相同溶液中:n(H+)/n(HA)=c(H+)/c(HA),所以其比值增大,故A错误;
B.加水稀释促进酸电离,酸浓度、酸根离子浓度都降低,但酸根离子浓度减小的量小于酸分子减小的量,所以c(HA)/c(A-)减小,故B正确;
C.c(H+)与c(OH-)的乘积为水的离子积,温度不变,水的离子积常数不变,故C错误;
D.加水稀释促进酸电离,氢离子浓度降低,但氢氧根离子浓度增大,故D错误;
故答案选B;
(4)等pH的HA溶液和盐酸,HA是弱酸,盐酸是强酸,所以HA的物质的量浓度大于盐酸,等体积等pH的HA和盐酸,HA的物质的量大于盐酸,所以向等体积、等pH的HA溶液和盐酸中分别加入足量Zn,产生的H2是HA多。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案