题目内容
【题目】一定温度压强下,用mg的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )
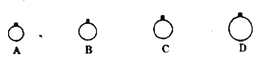
A.气球B中装的是O2
B.气球A和气球C中气体分子数相等
C.气球A和气球D中气体物质的量之比为4:1
D.气球C和气球D中气体密度之比为2:1
【答案】D
【解析】
试题分析:A、一定温度压强下,气体的Vm是相等的,用mg的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,则根据V=nVm=Vmm/M得到体积和相对分子质量成反比,所以体积的大小顺序是:CH4>O2>CO2>SO2,C中装的是氧气,A错误;B、根据A的分析,D、C、B、A四个球中分别是CH4、O2、CO2、SO2,气球A和气球C中气体分子数之比等于体积之比,等于相对分子质量M的倒数之比,即为32:64=1:2,B错误;C、气球A和气球D中气体物质的量之比等于体积之比,等于M的倒数之比,即为1:4,C错误;D、气球C和气球D中气体密度之比等于摩尔质量之比,即为:32:16=2:1,D正确,答案选D。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】碳及其化合物在能源、材料等方面具有广泛的用途。回答下列问题:
(1)碳酸和草酸(H2C2O4)均为二元弱酸,其电离均为分步电离,二者的电离常数如下表:
H2CO3 | H2C2O4 | |
K1 | 4.2×107 | 5.4×102 |
K2 | 5.6×1011 | 5.4×105 |
①向碳酸钠溶液中滴加少量草酸溶液所发生反应的离子方程式为_____________。
②浓度均为0.1 mol·L1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液,其溶液中H+浓度分别记作c1、c2、c3、c4。则四种溶液中H+浓度由大到小的顺序为________________。
(2)常温时,C和CO的标准燃烧热分别为394.0 kJ·mol1、283.0 kJ·mol1,该条件下C转化为CO的热化学方程式为____________________。
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下:2H2(g)+CO(g)![]() CH3OH(g) ΔH=Q kJ·mol1
CH3OH(g) ΔH=Q kJ·mol1
①该反应在不同温度下的化学平衡常数(K)如下表:
温度/℃ | 250 | 300 | 350 |
K/L2·mol2 | 2.041 | 0.270 | 0.012 |
由此可判断Q______(选填“ >”或“<”)0。
②一定温度下,将6 mol H2和2 mol CO充入体积为2 L的密闭容器中,10 min反应达到平衡状态,此时测得c(CO)=0.2 mol·L1,该温度下的平衡常数K=____,0~10 min内反应速率v(CH3OH)=______。
③在两个密闭容器中分别都充入20 mol H2和10 mol CO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:

若A点对应容器的容积为20 L,则B点对应容器的容积为____L。




