题目内容
【题目】碳及其化合物在能源、材料等方面具有广泛的用途。回答下列问题:
(1)碳酸和草酸(H2C2O4)均为二元弱酸,其电离均为分步电离,二者的电离常数如下表:
H2CO3 | H2C2O4 | |
K1 | 4.2×107 | 5.4×102 |
K2 | 5.6×1011 | 5.4×105 |
①向碳酸钠溶液中滴加少量草酸溶液所发生反应的离子方程式为_____________。
②浓度均为0.1 mol·L1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液,其溶液中H+浓度分别记作c1、c2、c3、c4。则四种溶液中H+浓度由大到小的顺序为________________。
(2)常温时,C和CO的标准燃烧热分别为394.0 kJ·mol1、283.0 kJ·mol1,该条件下C转化为CO的热化学方程式为____________________。
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下:2H2(g)+CO(g)![]() CH3OH(g) ΔH=Q kJ·mol1
CH3OH(g) ΔH=Q kJ·mol1
①该反应在不同温度下的化学平衡常数(K)如下表:
温度/℃ | 250 | 300 | 350 |
K/L2·mol2 | 2.041 | 0.270 | 0.012 |
由此可判断Q______(选填“ >”或“<”)0。
②一定温度下,将6 mol H2和2 mol CO充入体积为2 L的密闭容器中,10 min反应达到平衡状态,此时测得c(CO)=0.2 mol·L1,该温度下的平衡常数K=____,0~10 min内反应速率v(CH3OH)=______。
③在两个密闭容器中分别都充入20 mol H2和10 mol CO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:

若A点对应容器的容积为20 L,则B点对应容器的容积为____L。
【答案】 H2C2O4+ 2![]()
![]() 2
2![]() +
+![]() c4>c3>c2>c1 2C(s)+O2(g)
c4>c3>c2>c1 2C(s)+O2(g) ![]() 2CO(g) ΔH=222.0 kJ·mol1 < 2.041 L2·mol2 0.08 mol·L1·min1 4
2CO(g) ΔH=222.0 kJ·mol1 < 2.041 L2·mol2 0.08 mol·L1·min1 4
【解析】(1)由图表可知草酸的一级电离、二级电离均大于碳酸的一级、二级电离,即HC2O4-的酸性比H2CO3强,则向碳酸钠溶液中滴加少量草酸溶液所发生反应的离子方程式为H2C2O4+ 2![]()
![]() 2
2![]() +
+![]() ;②由碳酸和草酸的两步电离常数可知酸性强弱顺序为H2C2O4>
;②由碳酸和草酸的两步电离常数可知酸性强弱顺序为H2C2O4>![]() >H2CO3>
>H2CO3>![]() ,酸性越弱,其对应的强碱盐水解程度越大,盐溶液的碱性越强,c(H+)越小,故浓度均为0.1 mol·L-1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液中c(H+)逐渐增大,即c4>c3>c2>c1;(2)由已知C和CO的标准燃烧热数据可写出其热化学方程式:①C(s)+O2(g)
,酸性越弱,其对应的强碱盐水解程度越大,盐溶液的碱性越强,c(H+)越小,故浓度均为0.1 mol·L-1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液中c(H+)逐渐增大,即c4>c3>c2>c1;(2)由已知C和CO的标准燃烧热数据可写出其热化学方程式:①C(s)+O2(g)![]() CO2(g) ΔH=-394.0 kJ·mol-1、②CO(g)+
CO2(g) ΔH=-394.0 kJ·mol-1、②CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH=-283.0 kJ·mol-1,根据盖斯定律,由(①-②)×2可得:2C(s)+O2(g)
CO2(g) ΔH=-283.0 kJ·mol-1,根据盖斯定律,由(①-②)×2可得:2C(s)+O2(g)![]() 2CO(g) ΔH=(-394.0 kJ·mol-1+283.0 kJ·mol-1)×2=-222.0 kJ·mol-1;(3)①由表格中的平衡常数数据可知,温度越高,平衡常数越小,即升高温度,平衡逆向移动,故正反应为放热反应,即Q<0。②由题意可知,平衡时c(H2)=1.4 mol·L-1,c(CO)=0.2 mol·L-1,c(CH3OH)=0.8 mol·L-1,则K=
2CO(g) ΔH=(-394.0 kJ·mol-1+283.0 kJ·mol-1)×2=-222.0 kJ·mol-1;(3)①由表格中的平衡常数数据可知,温度越高,平衡常数越小,即升高温度,平衡逆向移动,故正反应为放热反应,即Q<0。②由题意可知,平衡时c(H2)=1.4 mol·L-1,c(CO)=0.2 mol·L-1,c(CH3OH)=0.8 mol·L-1,则K=![]() ≈2.041 L2·mol-2,v(CH3OH)=0.8 mol·L-1÷10 min=0.08 mol·L-1·min-1span>。③由图示可知B处的转化率高于A处,而已知反应为增大压强平衡正向移动的反应,因此压强p1<p2。达平衡状态A时,CO的转化率为0.5,此时CO为5 mol,H2为10 mol,CH3OH为5 mol;达平衡状态B时,CO的转化率为0.8,此时CO为2 mol,H2为4 mol,CH3OH为8 mol。由于温度相同,化学平衡常数相同。设V(B)为VL,则
≈2.041 L2·mol-2,v(CH3OH)=0.8 mol·L-1÷10 min=0.08 mol·L-1·min-1span>。③由图示可知B处的转化率高于A处,而已知反应为增大压强平衡正向移动的反应,因此压强p1<p2。达平衡状态A时,CO的转化率为0.5,此时CO为5 mol,H2为10 mol,CH3OH为5 mol;达平衡状态B时,CO的转化率为0.8,此时CO为2 mol,H2为4 mol,CH3OH为8 mol。由于温度相同,化学平衡常数相同。设V(B)为VL,则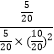 =
=![]() ,解得V=4。
,解得V=4。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案